
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:①O2中只含非极性键,属于单质;
②CO2 ③NH3、⑩HBr中只含极性键,属于共价化合物;
⑧H2O2 含有H-O极性键和O-O非极性键,属于共价化合物;
⑤Na2O2中含有离子键和非极性键,属于离子键化合物;
⑥NaOH、⑨NH4Cl中含有离子键和极性键,属于离子键化合物;
⑦CaBr2、④Na2O中只含离子键,属于离子化合物;
只含极性键的是②③⑩;含有极性键和非极性键的是⑧;含有非极性键的离子化合物是⑤;
故答案为:②③⑩;⑧;⑤.
点评 本题考查了物质和化学键的关系,明确物质中存在的化学键是解本题关键,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:实验题
 在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示.
在两支小试管中分别加入5mL 盐酸和5mL硫酸,再分别放入一段大小相同且纯度>99.5%铝片,实验现象如表所示. | 1min | 6min | 8min | 20min | |
| 3mol?L-1盐酸 | 少量 气泡 | 较多 气泡 | 大量气泡,出现灰色物质 | 气泡消失,溶液澄清透明 |
| 1.5mol?L-1 硫酸 | 无明显现象(无气泡) | |||
| 实验方案 | 现象 | 实验结论 | ||
| A | 3mol•L-1盐酸 | / | 产生较多气泡 | / |
| B | 3mol•L-1盐酸 | Na2SO4晶体少量 | 与A无明显差异 | 假设一:不成立. (填“成立”、“不成立”) |
| C | 1.5mol•L-1硫酸 | NaCl晶体少量 | 与A无明显差异 | |
| D | 3mol•L-1盐酸 | NaCl晶体少量 | 与A无明显差异 |
| E | 1.5mol•L-1硫酸 | 无现象 | ||
| F | 1.5mol•L-1硫酸 | 铝片用砂纸打磨 | 少量气泡后停止 | 假设二:成立. (填“成立”、“不成立”) |
| G | 1.5mol•L-1硫酸 | 铝片用食盐水泡1天再取出清洗 | 少量气泡后停止 | |
| H | 1.5mol•L-1硫酸 | 铝片插入Hg(NO3)2溶液再取出清洗 | 表面有较多气泡 | |
| I | 1.5mol•L-1硫酸 | 铝片插入Cu(NO3)2溶液再取出清洗 | 无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
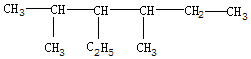 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,4-二甲基-3-乙基己烷 | B. | 3-异丙基-4-甲基已烷 | ||
| C. | 2-甲基-3,4-二乙基戊烷 | D. | 3-甲基-4-异丙基已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高溴酸(HBrO4)的酸性比硒酸(H2SeO4)的酸性弱 | |
| B. | 砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 | |
| C. | 铍的氧化物对应的水化物可能具有两性 | |
| D. | 硫酸锶(SrSO4)是难溶于水和盐酸的白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取、分液前需对分液漏斗检漏 | |
| B. | 进行分液时,分液漏斗中的下层液体,从下端流出,上层则从上口倒出 | |
| C. | 用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液 | |
| D. | 为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,C微粒的结构示意图为
,C微粒的结构示意图为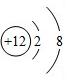 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
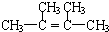 .
.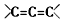 为不稳定结构.
为不稳定结构.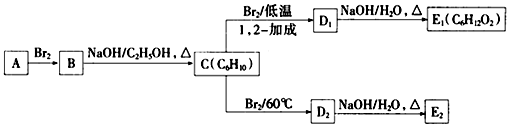
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com