
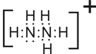
分析 (1)类比氨气的性质分析,N2H4叫联氨,又叫肼,是一种无色的高度吸湿性的可燃液体,在联氨中氮原子的孤电子对可以同H结合而显碱性,但其碱性不如氨强,联氨是一个二元弱碱,性质稳定;溶解情况,不溶于乙醚、氯仿和苯,能与水、甲醇、乙醇等混溶,与水能形成恒沸物,有吸湿性,在空气中发烟,燃烧时呈紫色火焰,液体中分子以二聚体存在,有强还原性和腐蚀性,高温加热时分解为氮气、氢气和氨气,2N2H4=2NH3↑+N2↑+H2↑,N2H4在空气中燃烧或与过氧化氢H2O2反应时,都能放出大量的热,因此可用作火箭燃料,做火箭的推进剂,有强还原性和腐蚀性;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,根据电子式的书写知识来回答;
(3)在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨,反应还生成碳酸钠、氯化钠与水;
(4)依据盖斯定律计算,将方程式2×②-①得到气态肼和NO2反应的热化学方程式;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,正极上氧气得电子和水反应生成氢氧根离子,据此分析解答.
解答 解:(1)A.具有高度吸湿性,在空气中发烟,燃烧时呈紫色火焰,故A正确;
B.不溶于乙醚、氯仿和苯,能与水、甲醇、乙醇等混溶,与水能形成恒沸物,故B正确;
C.N2H4的水溶液中氮原子的孤电子对可以同H+结合促进水的电离溶液显碱性,但其碱性不如氨强,故C正确;
D.液体中分子以二聚体存在,有强还原性和腐蚀性,无氧化性,故D错误;
E.高温加热时分解为氮气、氢气和氨气,2N2H4$\frac{\underline{\;高温\;}}{\;}$2NH3↑+N2↑+H2↑,故E正确;
故答案为:ABCE;
(2)N2H5+的内部氮原子和氢原子之间存在极性共价键,联氨分子中氮原子上的一个孤对电子结合氢离子形成阳离子N2H5+,电子式为: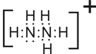 ,
,
故答案为: ;
;
(3)在高锰酸钾催化剂存在下,尿素(CO(NH2)2)和次氯酸钠-氢氧化钠溶液反应制得联氨,它和水能按任意比例互相混溶,形成稳定的水合肼N2H4•H2O,反应还生成碳酸钠、氯化钠,反应离子方程式为:CO(NH2)2+ClO-+2OH-=N2H4•H2O+Cl-+CO32-,
故答案为:CO(NH2)2+ClO-+2OH-=N2H4•H2O+Cl-+CO32-;
(4)①N2(g)+2O2(g)═2NO2(g),△H=+67.7KJ•mol-1;
②N2H4(g)+O2(g)═N2(g)+2H2O (g),△H=-534KJ•mol-1
将方程式2×②-①得2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2(-534KJ•mol-1)-(+67.7KJ•mol-1)=-1135.7kJ•mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ•mol-1;
(5)肼-空气燃料电池放电时,负极上肼失电子和氢氧根离子反应生成H2O和氮气,电极反应式为N2H4+4OH--4e-=N2↑+4H2O,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:N2H4+4OH--4e-=N2↑+4H2O.
点评 本题考查联氨结构和性质,热化学方程式书写和盖斯定律的应用,电极反应式的书写,注意要结合电解质溶液酸碱性书写电极反应式,联氨性质的推断需要结合知识积累和氨气结构、联氨结构及其题干信息理解判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ⑤⑦ | C. | ①④⑤ | D. | ②⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| B. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| C. | 溶液,浊液,胶体都属于混合物 | |
| D. | CO2、CO等非金属氧化物均属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 | |
| B. | 酸性高锰酸钾溶液可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 | |
| C. | 可以利用银镜反应证明反应①的最终产物为葡萄糖 | |
| D. | 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 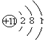 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com