
测血钙的含量时,可将2.0 mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀。将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若终点时用去20.0 mL 1.0×10-4 mol·L-1的KMnO4溶液。
(1)写出用KMnO4滴定H2C2O4的离子方程式 。
(2)判断滴定终点的方法是 。
(3)计算:血液中含钙离子的浓度为 g·mL-1。
科目:高中化学 来源: 题型:填空题
(12分)(1)已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数分别为:
醋酸 Ki = 1.75×10-5
碳酸 Ki 1= 4.30×10-7 Ki 2 = 5.61×10-11
亚硫酸 Ki 1= 1.54×10-2 Ki 2 = 1.02×10-7
写出碳酸的第一级电离平衡常数表达式:Ki = _ __
在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性最强的是
③ 若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是 (填序号)
A. c(CH3COO-) B. c(H+) C. w醋酸电离平衡常数 D. 醋酸的电离度  (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
Ksp=cm(An+)×cn(Bm-),称为难溶电解质的离子积。在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最后生成黑色沉淀。
下列叙述不正确的是  w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.若先加入Na2S溶液,再加入KCl溶液,则无白色沉淀产生
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积相同
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。
设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某温度(t℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积KW为________,则该温度t__________25℃(填“>”“<”或“=”),pH=7的溶液显________(填“酸”“碱”或“中”)性。
(2)若将此温度(t℃)下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计)。试通过计算填写以下不同情况时两种溶液的体积比。
①若所得混合液为中性,则a∶b=______________________________________;
②若所得混合液的pH=2,则a∶b=____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铬污染主要产生于铬矿的开采和冶炼。工厂排出的铬渣成分为SiO2、 A12O3、MgO、 Fe2O3、Na2Cr2O7等,其中危害最大的化学成分是Na2Cr2O7。已知:① Na2Cr2O7易溶于水,是强氧化剂。② +6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。下面是实验室模拟处理铬渣、消除铬污染的工艺流程如下(部分操作和条件略):
(1)在酸浸过程中,稀H2SO4溶解A12O3的离子方程式是 。
(2)过滤1后的滤液中存在如下平衡:Cr2O72-(橙色)+ H2O  2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
2CrO42-(黄色)+ 2H+,此时溶液应呈现的颜色是 。
(3)用FeSO4·7H2O还原 Na2Cr2O7的离子方程式是 。
(4)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Cr(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀 | 1.5 | 3.4 | 4.9 | 6.3 | 9.6 |
| 完全沉淀 | 2.8 | 4.7 | 5.5 | 8.3 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表列出了某冷轧厂排放的废水中各成分的含量及国家环保标准值的有关数据:
| | 冷轧含锌 废水水质 | 经处理后的水国 家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
| SO42-浓度/(mg·L-1) | ≤23 000 | ≤150 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知25°C时:
| 电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积 | 1.8×10-11 | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 完全沉淀时的pH | 9.7 | 5.0 | 5.5 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。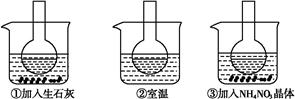
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是 。
| A.水解反应为放热反应 | B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 | D.NH4NO3溶于水时吸收热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com