
【题目】向质量为6.5g的Al和Fe的混合物中加入一定量稀HNO3恰使混合物完全溶解,放出NO(标准状况)2.24L,所得溶液中再滴加KSCN溶液,无红色出现。若用相同质量的上述混合物与足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为( )
A.15.12LB.10.08LC.2.24LD.3.36L
科目:高中化学 来源: 题型:
【题目】以下反应均可生成![]() 。下列有关说法正确的是
。下列有关说法正确的是![]()
![]() 二氧化碳分解生成氧气:
二氧化碳分解生成氧气:![]() ;
;![]()
![]() 过氧化氢分解生成氧气:
过氧化氢分解生成氧气:![]() ;
;![]()
![]() 光照条件下,催化分解水蒸气生成氧气:
光照条件下,催化分解水蒸气生成氧气:![]() ;
;![]() 。
。
A.反应![]() 使用催化剂,能降低该反应的活化能
使用催化剂,能降低该反应的活化能
B.反应![]() 为吸热反应
为吸热反应
C.反应![]() 将化学能转化为光能
将化学能转化为光能
D.反应![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应2A ( g)+B(g)![]() 2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
2C(g),若经2 s后测得C的浓度为0.6 mol· L-1,现有下列几种说法,其中正确的是 ( )
A.用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
C.2 s时物质A的转化率为70%
D.2 s时物质B的浓度为0.7 mol · L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对世界范围内的能源危机,甲醇作为一种可再生能源,有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:____
(2)对于CO(g)+2H2(g)CH3OH(g) ΔH1=-90 kJ·mol-1,在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。
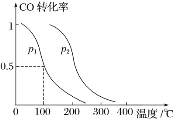
①p1 _______(填“大于”“小于”或“等于”) p2。
②在其他条件不变的情况下,缩小体积使压强增大,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”),平衡常数________(填“增大”“减小”或“不变”)。
(3)已知在温度T时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,判断此时刻υ正________(填“>” 、“=”或“<”)υ逆。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据如图回答下列问题:

(1)写出结构简式:B___,D___。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②__,反应类型__。
④__,反应类型__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年诺贝尔生理学或医学奖的一半授予我国药物化学家屠呦呦,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素。以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图)。下列说法正确的是

A.异胡薄荷醇的分子式为C10H17O
B.异胡薄荷醇在NaOH醇溶液中可发生消去反应
C.青蒿素分子中含有7个手性碳原子
D.青蒿素在热的酸、碱溶液中均可稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——有机化学基础]
某吸水材料与聚酯纤维都是重要化工原料,它们的合成路线如下:
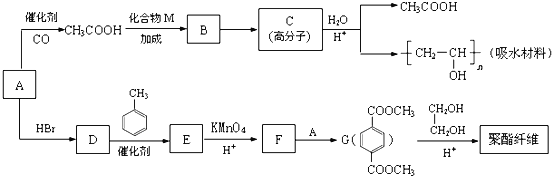
已知:①有机物A能与Na反应,相对分子质量为32。
②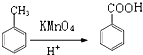
③RCOOR′+R″OH![]() RCOOR″+R′OH(R、R、R,代表烃基)
RCOOR″+R′OH(R、R、R,代表烃基)
(1)A的结构简式是____________,B中含氧官能团的名称是_____________。
(2)C的结构式是_______________,D→E的反应类型是_________________。
(3)F+A→G的化学方程式是_________________________。
(4)CH3COOH+CH≡CH→B的化学方程式是______________。
(5)G的同分异构体有多种,满足下列条件的共有___________种。
①苯环上只有两个取代基
②1mol与足量的NaHCO3溶液反应生成2mol CO2气体
(6)G→聚酯纤维的化学方程式是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质的化学用语正确的是( )
A.![]() C表示的是核内有13个中子,核外有8个电子
C表示的是核内有13个中子,核外有8个电子
B.H3O+与OH-具有相同的质子数和电子数
C.NaOH的电子式:![]()
D.HClO的结构式:H—Cl—O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着氮氧化物对环境及人类活动影响的日趋严重,如何消除大气污染物中的氮氧化物成为人们关注的主要问题之一。
Ⅰ.利用NH3的还原性可以消除氮氧化物的污染,其中除去NO的主要反应如下:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H<0
5N2(g)+6H2O(l) △H<0
(1)写出一种可以提高NO的转化率的方法:__________
(2)一定温度下,在恒容密闭容器中按照n(NH3)︰n(NO) =2︰3充入反应物,发生上述反应。下列不能判断该反应达到平衡状态的是___________
A.c(NH3)︰c(NO) =2︰3 B.n(NH3)︰n(N2) 不变 C.容器内压强不变 D.容器内混合气体的密度不变 E.1molN—H键断裂的同时,生成1molO—H键
(3)已知该反应速率v正=k正·c4(NH3)·c6 (NO),v逆=k逆·cx(N2)·cy(H2O) (k正、k逆分别是正、逆反应速率常数),该反应的平衡常数K=k正/k逆,则x=_____,y=_______。
(4)某研究小组将2molNH3、3molNO和一定量的O2充入2L密闭容器中,在Ag2O催化剂表面发生上述反应,NO的转化率随温度变化的情况如图所示:

①在5min内,温度从420K升高到580K,此时段内NO的平均反应速率v(NO)=_______;
②在有氧条件下,温度580K之后NO生成N2的转化率降低的原因可能是___________。
Ⅱ.用尿素[(NH2)2CO]水溶液吸收氮氧化物也是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如图。

(5)用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。写出该反应的化学方程式____。
(6)随着NO和NO2配比的提高,总氮还原率降低的主要原因是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com