
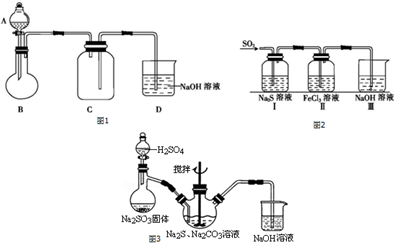
分析 (1)根据图1装置可知,二氧化硫密度大于空气,所以收集二氧化硫时应长时短出,B中发生反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,二氧化硫会污染空气,所以要进行尾气吸收;
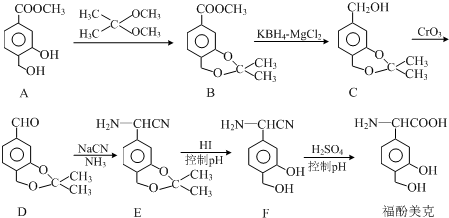
(2)二氧化硫通入硫化钠溶液发生氧化还原反应生成淡黄色沉淀硫单质,说明二氧化硫具有氧化性,氧化硫离子生成硫单质,足量二氧化硫和硫化钠溶液反应得到硫单质和亚硫酸氢钠;
(3)过量的二氧化硫能溶于水,也能使高锰酸钾褪色,据此判断;
(4)实验室可通过Na2S、Na2CO3和SO2共同反应生成二氧化碳和Na2S2O3.
解答 解:(1)根据图1装置可知,二氧化硫密度大于空气,所以收集二氧化硫时应长时短出,所以C处有错,装置B中发生的反应为亚硫酸钠和浓硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;二氧化硫会污染空气,所以D的作用是进行尾气吸收,
故答案为:集气瓶C中导管长短反了;Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;吸收尾气中的SO2,防止污染环境;
(2)二氧化硫通入硫化钠溶液发生氧化还原反应生成淡黄色沉淀硫单质;足量二氧化硫和硫化钠溶液反应得到硫单质和亚硫酸氢钠,反应的离子方程式为:2S2-+5SO2+2H2O=3S↓+4HSO3-,
故答案为:有浅黄色沉淀生成;2S2-+5SO2+2H2O=3S↓+4HSO3-;
(3)过量的二氧化硫能溶于水,也能使高锰酸钾褪色,所以方案一不合理,反应的离子方程式为:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,
故答案为:方案一;过量的二氧化硫能溶于水,也能使高锰酸钾褪色; 5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+;
(4)实验室可通过Na2S、Na2CO3和SO2共同反应生成二氧化碳和Na2S2O3,反应的化学方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 ,
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 .
点评 本题考查了物质制备、性质方案的设计,题目难度中等,涉及了二氧化硫性质、离子方程式书写、实验方案的设计与评价等知识,明确实验目的、实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 元素的最高正化合价在数值上一定等于它所在的族序数 | |
| B. | 同周期主族元素的原子半径越小,越难得到电子 | |
| C. | 氟气能从溴化钾溶液中置换出溴单质 | |
| D. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. 任意一种.
任意一种. $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 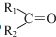 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以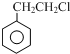 为原料制备
为原料制备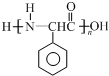 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
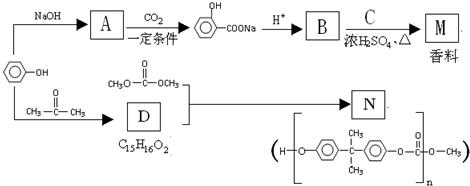
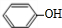 +NaOH→
+NaOH→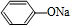 +H2O.
+H2O. ;
;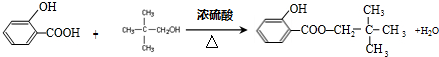 .
.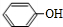 +
+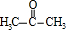 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$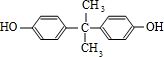 +H2O由D生成N的反应类型是缩聚反应
+H2O由D生成N的反应类型是缩聚反应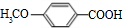 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
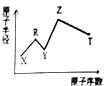 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 与同主族元素的氢化物相比较,R和Y的氢化物最稳定 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | P/MPa | |
| 200℃ | 2.000 | 0.0400 | 0.0300 | 0.0300 | 3.93 |
| 335℃ | 2.005 | 0.0500 | 0.0250 | 0.250 | P |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com