
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.

科目:高中化学 来源: 题型:
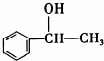 所示.
所示.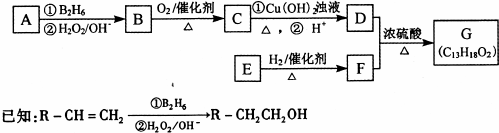
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中的硅,在元素周期表中处于金属与非金属的交界位置 |
| B、煤的气化或液化技术,可以降低污染 |
| C、镁粉可用来作信号弹和烟花,氧化镁可制作耐高温材料 |
| D、NaHCO3能与碱反应,因此食品工业用小苏打做焙制糕点的膨松剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
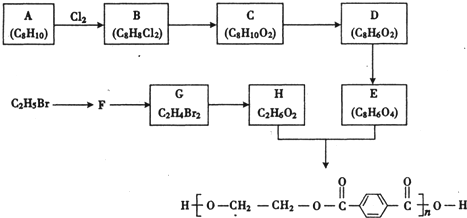
| 试剂a |
查看答案和解析>>
科目:高中化学 来源: 题型:
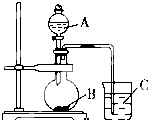
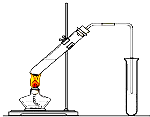 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石蕊层仍为紫色,有机层无色 |
| B、石蕊层为三层环,由上而下是红、紫、红 |
| C、石蕊层有两层,上层为紫色,下层为蓝色 |
| D、石蕊层为三层环,由上而下是蓝、紫、红 |
查看答案和解析>>
科目:高中化学 来源: 题型:
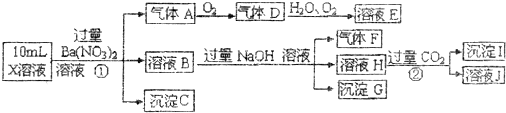
查看答案和解析>>
科目:高中化学 来源: 题型:
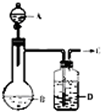 为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.
为了制取干燥纯净的气体C,可用如下图所示装置.生成C的速度可通过调节滴入液体A的速度的方法来控制,已知C是一种无色无味、不能使酸碱指示剂变色,也不会在空气中燃烧的气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com