
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施能提高COCl2转化率的是( )
A.降温B.增加CO的浓度C.恒容通入惰性气体D.恒压通入惰性气体
【答案】D
【解析】
化学反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,正反应是气体体积增大的吸热反应。
CO(g)+Cl2(g) ΔH>0,正反应是气体体积增大的吸热反应。
A.正反应为吸热反应,降温平衡向放热方向移动,故平衡左移;
B.增加CO的浓度,平衡逆向进行;
C.恒容通入惰性气体,总压增大,分压不变,平衡不动;
D.恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行;
COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,正反应是气体体积增大的吸热反应
CO(g)+Cl2(g) ΔH>0,正反应是气体体积增大的吸热反应
A.正反应为吸热反应,降温平衡向放热方向移动,故平衡左移,COCl2转化率下降,故A项错误;
B.增加CO的浓度,平衡向逆反应方向移动,COCl2转化率减小,故B错误;
C.恒容通入惰性气体,总压增大,反应混物各组分的浓度不变,平衡不移动,COCl2转化率不变,故C错误;
D.恒压通入惰性气体,压强增大,为保持恒压,体积增大压强减小,平衡正向进行, COCl2转化率增大,故D正确;
故选D。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)+ NaOH(aq) ==NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq) ==NaCl (aq)+H2O(l) ΔH=-55.6 kJ·mol-1
则HCN在水溶液中电离的ΔH等于
A.+43.5 kJ·mol-1 B .+67.7 kJ·mol-1
C.-43.5 kJ·mol-1 D.-67.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与所对应的离子方程式正确的是
A. 室温下,测定醋酸钠溶液的pH > 7:CH3COONa === CH3COO-+Na+
B. 实验室用氯化铝溶液和氨水制备氢氧化铝:Al3+ +3OH- === Al(OH)3↓
C. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3 + 2H+ === SO2 ↑ + S↓+ 2Na+ + H2O
D. 用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4(s) + CO32-(aq) === CaCO3(s) + SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
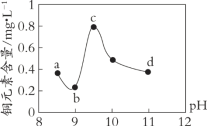
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了研究Mg(OH)2溶于铵盐溶液的原因,进行如下实验:
①向2mL 0.2mol/LMgCl2溶液中滴加1mol/LNaOH溶液至不再产生沉淀,将浊液分为2等份。
②向一份中逐滴加入4mol/L NH4Cl溶液,另一份中逐滴加入4mol/L CH3COONH4溶液(pH≈7),边滴加边测定其中沉淀的量,沉淀的量与铵盐溶液的体积的关系如图。
③将①中的NaOH溶液用氨水替换,重复上述实验。
下列说法不正确的是

A. Mg(OH)2浊液中存在:Mg(OH)2(s)![]() Mg2+(aq)+2OH﹣(aq)
Mg2+(aq)+2OH﹣(aq)
B. ②中两组实验中均存在反应:Mg(OH)2+2NH4+=Mg2++2NH3H2O
C. H+可能参与了NH4Cl溶液溶解Mg(OH)2的过程
D. ③中获得的图象与②相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1 mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
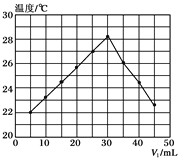
A. 做该实验时环境温度为22℃
B. NaOH溶液的浓度约为1.5mol/L
C. 该实验中需要使用环形玻璃搅拌棒在水平方向轻轻转动搅拌
D. 该实验可用相同物质的量的氢氧化钠固体投入盐酸中测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A.由水电离出的c(H+)=10-13molL-1的溶液:K+、Ba2+、Cl-、CO32-
B.使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+
C.常温下![]() =1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
=1012的溶液中:Fe2+、Mg2+、NO3-、Cl-
D.0.1molL-1盐酸的澄清透明溶液中:Fe3+、K+、SO42-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解法制备硼酸[H3BO3或B(OH) 3]的工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。下列有关说法正确的是( )

A. 阴极与阳极产生的气体体积比为1:2 B. b极的电极反应式为2H2O-2eˉ=O2↑+4H+
C. 产品室中发生的反应是B(OH)3+OHˉ=B(OH)4ˉ D. 每增加1 mol H3BO3产品,NaOH溶液增重22g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com