
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
(1)K2SiF6+3H2O=2KF+H2SiO3+4HF(2分) HF+OH—=F—+H2O (2分)
(2)偏高(2分)
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml(2分)
关系式:SiO2~Si~4HF~4NaOH
60g 4mol
m(SiO2) 20.00×10—3L×1.0mol·L-1
求得m(SiO2)=0.30g(2分)
硅元素的质量分数(以二氧化硅计):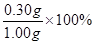 =30%(2分)
=30%(2分)
解析试题分析:(1)过滤除去硅酸沉淀,溶液中HF与氢氧化钠溶液反应;(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,导致滴定管中氢氧化钠溶液浓度降低,滴定相同量HF消耗的体积增大,故测得的硅元素含量将偏高;(3)剔除偏差较大的读数(16.80),平均体积为20.00mL,根据关系式计算可得。
考点:考查滴定计算及误差分析等有关问题。


科目:高中化学 来源: 题型:单选题
下列关于实验原理或操作的叙述中,正确的是
| A.可用重结晶法提纯含少量氯化钠杂质的硝酸钾晶体 |
| B.可摘下几根火柴头,将其浸入水中,所刻后取少量溶液于试管中,滴加硝酸银和稀硝酸以检验其中的氯元素 |
| C.“硝基苯制备”实验中,将硝酸与苯混合后再滴加浓硫酸 |
| D.实验时手指不小心沾上苯酚,立即用70℃以上的热水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据图示及描述,回答下列问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气? (填“漏气”、“不漏气”或“无法确定”),判断理由 。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气? (填“漏气”、“不漏气”或“无法确定”),判断理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮可以去除油污,还可以____________________。
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是_____→洗涤→_____。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。请写出酸性条件下K2Cr2O7与Fe2+反应的离子方程式 (K2Cr2O7被还原为Cr3+)。
(5)若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留四位有效数字,已知M(K2Cr2O7)="294.0" g·mol-1)。配制该标准溶液时,下列仪器一定不要用到的有 (用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250 mL容量瓶 ⑥胶头滴管 ⑦托盘天平
(6)若配制K2Cr2O7标准溶液时,俯视刻度线,则测定结果_______(填“偏大”、“偏小”或“不变”,下同);滴定操作中,若滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是 (填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式: 。
写出加入碳酸铵所发生反应的离子方程式: 。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用18.4 mol·L-1的浓硫酸配制100 mL浓度为1 mol·L-1的稀硫酸,其操作可分为以下各步:
| A.用量筒量取5.4 mL浓硫酸,缓慢倒入装有约50 mL蒸馏水的烧杯里,并用玻璃棒搅拌 |
| B.用约30 mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将洗涤液都倒入容量瓶中 |
| C.将稀释后的硫酸小心地倒入容量瓶中 |
| D.检查100 mL容量瓶口是否有漏液现象 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
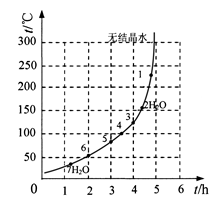
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(4分)下列有关实验操作或判断不正确的是 _____________(填序号,多选扣分)。
| A.配制一定物质的量浓度溶液,定容时俯视刻度线会导致所配溶液浓度偏大 |
| B.少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| C.配制稀硫酸时,可先在烧杯中加入一定体积的蒸馏水,再边缓慢加入浓硫酸边搅拌 |
| D.100 mL容量瓶可用于配制95 mL 0.1 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学进行硫酸铜晶体结晶水含量的测定实验。完成下列填空:
【实验步骤】
(1)用_______(填仪器名称,下同)准确称量瓷坩埚的质量。
(2)在瓷坩埚中加入约2 g研细的硫酸铜晶体,并称量。
(3)把盛有硫酸铜晶体的瓷坩埚放在泥三角上慢慢加热,直到蓝色完全变白,然后把坩埚移至____________中冷却到室温,并称量。
(4)重复(3)的实验进行恒重操作,直至两次称量结果相差不超过0.001 g。
【数据记录与处理】
| | 第一次实验 | 第二次实验 |
| 坩埚的质量(g) | 29.563 | 30.064 |
| 坩埚+试样的质量(g) | 31.676 | 32.051 |
| 恒重后,坩埚+硫酸铜的质量(g) | 30.911 | 31.324 |
| x的值 | 5.05 | 5.13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com