
(1)电解过程中阳极的电极反应分别为__________________、_________________;
(2)阴极生成的气体体积为____________L(标准状况);
(3)若将阳极生成的气体通人电解后的溶液中,充分反应后,则所得溶液中离子的浓度由大到小依次是_______________________________;
(4)常温下,若将电解后的溶液稀释至
(5)若将电解后阳极所产生的气体全部通入1 mol/L 500 mL NaSO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中![]() 的物质的量浓度最多为____________。
的物质的量浓度最多为____________。
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:阅读理解
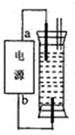 (2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
(2009?江门一模)某研究性学习小组设计了一个环保型消毒液发生器,如图所示装置,用一石墨作电极电解饱和NaCl溶液,请你完成以下实验探究过程:
| ||
| ||
| 假设 | 实验操作 | 预期现象 | 结论 |
| ①有明显现象 | 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 用烧杯取少量消毒液,将一颗光亮的铁钉放入烧杯,浸泡一段时间 |
铁定表面出现铁锈 铁定表面出现铁锈 |
铁定被锈蚀 铁定被锈蚀 |
| ②无明显现象,要进一步探究 | 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 用试管取少量(实验①)浸泡后的溶液,滴加足量的1mol/L的硫酸酸化,再用滴管滴加几滴20%的KSCN溶液 |
溶液不变色或溶液显血红色 溶液不变色或溶液显血红色 |
铁钉可能未被腐蚀也可能被腐蚀 铁钉可能未被腐蚀也可能被腐蚀 |
查看答案和解析>>
科目:高中化学 来源:山东省胜利油田一中2012届高三下学期第一次调研考试化学试题 题型:022
工业上用CH4和H2O为原料通过下列反应在一定条件下制备新型燃料甲醇,反应如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
请按要求回答下列问题:
(1)将0.20 mol CH4和0.30 mol H2O(g)通入容积为2 L的密闭容器中,在一定条件下发生反应①,达到平衡时CH4的转化率与温度、压强的关系如下图.当温度不变缩小体积时此反应的逆反应速率(填“增大”、“减小”或“不变”)________;ΔH1________0,p1________p2(均填“<”、“=”或“>”);p1、100℃时平衡常数的值K=________.

(2)为了探究反应②合成甲醇适宜的温度和压强,某同学设计了以下三组实验,部分实验条件已经填在下面实验设计表中,请在空格中填入剩余的实验条件数据.

若在300℃时其他条件不变,将该反应容器容积压缩到原来的1/2,重新平衡时CH3OH的物质的量的变化是________,K的变化是________(均填“增大”,“减小”或“不变”).
(3)已知在常温常压下:2CH3OH(I)+3O2(g)![]() 2CO2(g) ΔH=-1275.6 kJ/mol
2CO2(g) ΔH=-1275.6 kJ/mol
H2O(g)=H2O(I) ΔH=-44.0 kJ/mol,请计算32 g新型燃料甲醇完全燃烧生成液态水放出热量为________kJ.
(4)新型燃料甲醇还可以用做燃烧电池,其反应原理如下图所示,电池工作时电子移动方向是(极板用M、N表示)________,负极电极反应式为________.

若以该燃料电池作为电源,用石墨作电极电解500 mL饱和食盐水,当两极共收集到1.12 L(标准状况下、不考虑气体的溶解及反应)时,常温下所得溶液的pH=________(假设反应前后溶液体积不变).
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;②被转移人群应戴上用浓NaOH溶液处理过的口罩;③用高压水枪向空中喷洒含碱性物质的水溶液;④被转移人群可戴上用Na2CO3溶液处理过的口罩(湿润);⑤将人群转移到地势较低的地方即可,不必走太远;⑥及时清理现场,检查水源和食物等是否被污染;⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
据报道,为防止罐中液氯再次泄漏,4月1日抢救人员将盛液氯的罐吊到事故发生地附近刚挖好的水塘中,用烧碱溶液处理。写出反应的离子方程式____________________________。
(2)用氯气对饮用水消毒已有百年历史。这种消毒方法会使饮用水中的有机物发生氯代,生成含氯的有机化合物,对人体有害,世界环保联盟即将全面禁止用氯气对饮用水消毒,建议推广采用广谱高效消毒剂二氧化氯(ClO2)。
我国最近研究成功了用氯气氧化亚氯酸钠(在氮气保护下)制得ClO2,表示这一反应的化学方程式是______________,在H2SO4的酸性条件下,用Na2SO3还原NaClO3也可制得ClO2,在以上反应中NaClO3和Na2SO3的物质的量之比为_______。
(3)一化学课外活动小组的同学制作了一种家用环保型消毒液发生器(如图1-3-3),用石墨作电极电解饱和氯化钠溶液,可制得少量消毒剂。为了研究各电极的产物,反应开始后沿玻璃管滴几滴酚酞试液到溶液中,发现上层溶液变红,一段时间后,红色消失。则与电源a端相连的电极上发生的电极反应式为____________________。

图1-3-3
该小组同学经查阅资料后认为褪色的原因可能有两个:一是氢氧化钠浓度过大;二是。小华设计了一个简单的实验,只需要一种试剂,便获得了有关褪色原因的结论,请简要写出小华设计的实验方案:______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省滨州市高三3月模拟(一模)考试化学试卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂。已知:NaClO2饱和溶液在温度低于38oC时析出的晶体是NaClO2·3H2O,高于38oC时析出晶体是NaClO2,高于60oC时NaClO2分解成NaClO3和NaCl。利用下图所示装置制备亚氯酸钠。装置②反应容器为三颈烧瓶。
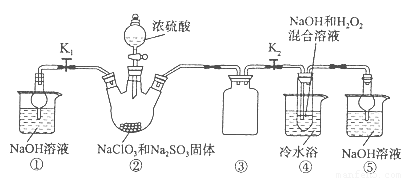
完成下列填空:
(1)组装好仪器后,检查整套装置气密性的操作是:??????????????????? 。
(2)装置②中产生ClO2的化学方程式为 ??????????????????????????????? 。
装置④中发生反应的离子方程式为????????????????????????????????? 。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55oC蒸发结晶;②????? ;③????? ;④低于60oC干燥,得到成品。
(4)目前已开发出用电解法制取ClO2的新工艺。
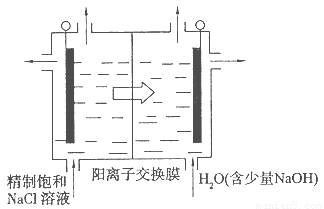
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生C1O2的电极反应为 ????????????? 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为??? mol。
(5)准确称取所得亚氯酸钠样品l0 g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+=2H2O+2I2+C1-)。将所得混合液配成250 mL待测溶液。配制待测液需用到的定量玻璃仪器是????? ;取25.00 mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为?????????? 。重复滴定2次,测得Na2S2O3溶液平均值为20.00 mL。该样品中NaClO2的质量分数为???????? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)将N2H4完全燃烧反应设计为肼-空气燃料电池,用石墨作电极电解500mL足量的饱和氯化钠溶液,当两极共产生1.12L气体时,溶液的pH为 ,则肼-空气燃料电池理论上消耗的空气 L(气体体积在标准状况下测定,假设空气中氧气体积分数为20%)
(3)某种晶体的晶胞为立方体,结构如下图所示:通过观察和计算,回答下列有关问题:

① 晶体中每个Mg2+周围与它最邻近的Mg2+围成的空间构型是 ,每个F―周围与它最邻近的K+ 有 个。该晶体的化学式为
② 若将该晶体重新切割晶胞,使Mg2+置于晶胞的体心,K+ 置于晶胞的顶点,F―应占据立方体的 位置。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com