
| A、NH3 |
| B、PCl5 |
| C、COCl2 |
| D、BF3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
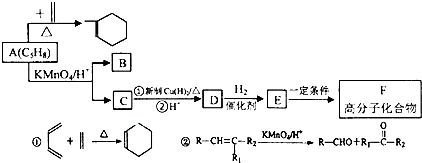
 时,A发生的反应类型为
时,A发生的反应类型为查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验用品 | 溶液 体积* | 溶液温度 | 中和热(△H) | ||
| t1 | t2 | ||||
| a | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.3℃ | |
| 0.5 mol?L-1 HCl溶液 | 50 mL | ||||
| b | 0.55 mol?L-1 NaOH溶液 | 50 mL | 20℃ | 23.5℃ | |
| 0.5 mol?L-1 HCl 溶液 | 50 mL | ||||
. |
| △t |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SCl2、PCl3、CO2 |
| B、AsH3、BF3、BeCl2 |
| C、XeF2、PCl5、ClO2 |
| D、H2SO3、CO2、BrF3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、混合酸中NO3-物质的量为2mol?L-1 |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、混合酸中H2SO4 的物质的量的浓度为2.5mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com