
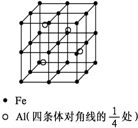
 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.分析 (1)①根据元素周期表电负性的递变规律比较电负性强弱;
②A.甲醛和水分子间能形成氢键,所以CH2O易溶于水;B.二氧化碳分子中C原子为sp杂化;C.苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键;D.原子晶体的熔沸点大于分子晶体;
③碳为四价,氮为三价,氧为两价,氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,故N≡C-O-H;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质;
(3)根据Ti原子核外电子排布式解答;
(4)①根据均摊法计算化学式;
②计算出晶胞边长,即可进一步求出最近的两个Fe原子之间的距离.
解答 解:(1)①同周期元素从左到右元素的电负性逐渐增大,则有电负性C<N<O,H的电负性最小,电负性顺序为:H<C<N<O,
故答案为:H<C<N<O;
②A.A中甲醛中含有羟基,与水可以形成氢键,故A正确;
B.HCHO分子中C原子采用sp2杂化,但二氧化碳分子中C原子为sp杂化,故B错误;
C.C2H2是直线型对称结构,为非极性分子,但苯中碳碳键含有6个σ键,每个碳氢键含有一个σ键,苯分子中一共含有12个,故C错误;
D.二氧化碳晶体是分子晶体,二氧化硅晶体是原子晶体,所以CO2晶体的熔点、沸点都比二氧化硅晶体的低,故D正确,
故答案为:BC;
③氰酸(HOCN)是一种链状分子,且其分子内各原子最外层均已达到稳定结构,碳为四价,氮为三价,氧为两价,故N≡C-O-H,
故答案为:N≡C-O-H;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,
故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,
故答案为:B;N2;
(3)Ti原子核外电子排布为1s22s22p63s23p63d24s2,钛位于第四周期第ⅣB族,属于d区,故答案为:d;
(4)①Fe位于顶点、面心、体心和棱心,数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$+1+12×$\frac{1}{4}$=8,Al位于晶胞体心,数目为4,原子数目比值为2:1,化学式可写为:Fe2Al,
答:化学式为Fe2Al;
②晶胞质量为:$\frac{4}{N{\;}_{A}}$×(56×2+27)g,设晶胞边长为a cm,则晶胞体积为a3cm3,由密度公式得:ρ×a3=$\frac{4}{N{\;}_{A}}$×(56×2+27),解得a=2×$\root{3}{\frac{139}{2N{\;}_{A}ρ}}$,两个Fe原子之间的距离为边长的一半,则距离为:$\frac{1}{2}$×a cm=$\root{3}{\frac{139}{2N{\;}_{A}ρ}}$cm,
故答案为:$\root{3}{\frac{139}{2N{\;}_{A}ρ}}$.
点评 本题考查了物质结构和性质,题目比较综合,侧重对物质结构主干知识的考查,涉及电负性、杂化理论、化学键、分子结构与性质、晶体类型与性质、晶胞计算等,需要学生具备知识的基础,难度中等.


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| A. | C | B. | CO | C. | CH4 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,实验式是CH2.
,实验式是CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 实验 | 现象 |
| A | 检验CO2气体中混有SO2 | 将气体通入盛有足量的澄清石灰水中的洗气瓶中 | 石灰水变浑浊 |
| B | 检验黑色固体Fe3O4中含有+3价铁元素 | 将少量黑色固体加入盛有KSCN溶液的烧杯中 | 固体溶解,溶液呈血红色 |
| C | 实验室制取并收集少量NH3 | 加热NH4Cl固体,并用向上排空气法收集,将湿润的红色石蕊试纸放在瓶口 | NH4Cl固体逐渐变少,湿润的红色石蕊试纸变蓝色 |
| D | 验证氧化性:Fe3+>Cu2+ | 将一定量铜粉加到盛有一定体积的1.0mol•L-1Fe2(SO4)3溶液的试管中 | 铜粉溶解,溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

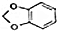
 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O
+NaBr+H2O (写出其中一种的结构简式).
(写出其中一种的结构简式).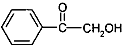 的合成路线.
的合成路线. $→_{△}^{Cl_{2}}$
$→_{△}^{Cl_{2}}$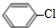 $→_{AlCl_{3}}^{CH_{3}CHO}$
$→_{AlCl_{3}}^{CH_{3}CHO}$ $→_{H_{2}SO_{4}}^{NaBr/FeBr_{2}}$
$→_{H_{2}SO_{4}}^{NaBr/FeBr_{2}}$ $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molCl2常温下与过量稀NaOH溶液反应转移电子总数为0.1NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 标准状况下,22.4LCHCl3含有的分子数为NA | |
| D. | 1L 0.1mol•L-1的硫化钠溶液中硫离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气极易溶于水,可用作制冷剂 | |
| B. | 乙醇燃烧时放出热量,可用作燃料 | |
| C. | 碳酸氢钠能与盐酸反应,用作治疗胃酸过多 | |
| D. | 葡萄糖能与银氨溶液反应,可用作制镜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com