
【题目】向含下列离子的溶液中分别加入NaOH固体(溶液体积不变),能引起离子浓度减小的是
A. Cl- B. OH- C. AlO2- D. HCO3-
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效氧化剂、漂白剂.已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.利用如图所示装置制备亚氯酸钠.
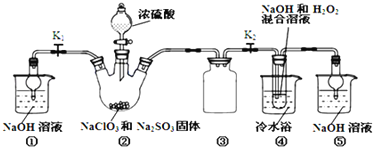
完成下列填空:
(1)装置②中产生ClO2的化学方程式为______.装置③的作用是______.
(2)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②______;③______;④低于60℃干燥,得到成品.(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
(3)准确称取所得亚氯酸钠样品10g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2﹣+4I﹣+4H+═2H2O+2I2+Cl﹣).将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是______;
(4)取25.00mL待测液,用2.0mol/L Na2S2O3标准液滴定(I2+2S2O32﹣═2I﹣+S4O62﹣),以淀粉溶液做指示剂,达到滴定终点时的现象为________________________________.重复滴定2~3次,测得所用Na2S2O3溶液体积的平均值为20.00mL.该样品中NaClO2的质量分数为______.
(5)Na2FeO4和ClO2在水处理过程中分别被还原为Fe3+和Cl﹣.如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > .______(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g) = CO2(g)+3H2(g);△H = + 49.0 kJ·mol-1
②CH3OH(g)+O2(g) = CO2(g)+2H2(g);△H =-192.9 kJ·mol-1
下列说法正确的是( )

A. CH3OH的燃烧热为192.9 kJ·mol-1
B. 反应①中的能量变化如图所示
C. CH3OH转变成H2的过程一定要吸收能量
D. 根据②推知反应:CH3OH(l)+ O2(g) = CO2(g)+2H2(g)的△H >-192.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物完全燃烧生成标准状况下CO2的体积为4.48 L,H2O的质量为5.4 g ,
(1)若此有机物的质量为3 g,则此有机物的结构简式是_________________________;
(2)若此有机物的质量为4.6 g,则此有机物的分子式是________________________;
(3)若此有机物的质量为6.2 g,且此有机物1mol能和金属钠反应生成1 mol H2,则此有机物的结构简式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
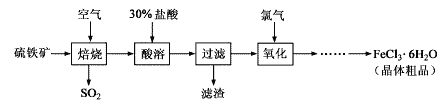
(1)氧化过程中发生反应的离子方程式是__________________,检验氧化生成的阳离子的试剂是________________。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气V L测定SO2含量:
方案一:让尾气缓慢通过以下装置。
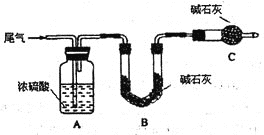
①装置c的作用是____________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理__________,请说明理由__________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g。
①SO2含量的表达式是_____________(用含m、V的代数式表示)。
②从FeCl3溶液中得到FeCl3![]() 6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
6H2O晶体的操作包括_____、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向10mL0.1mol/L的HR溶液中逐渐滴入0.1mol/L的NH3·H2O溶液, 所得溶液pH及导电性变化如图。下列分析不正确的是

A.a~b点导电能力增强,说明HR为弱酸
B.b点溶液pH=7,说明NH4R没有水解
C.c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D.b~c任意点溶液均有c(H+)×c(OH-)=Kw=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学欲探究SO2的性质,并测定空气中SO2的含量。他们设计如下实验装置(如图),请你参与探究,并回答问题:
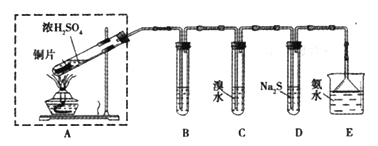
(1)装置E中的氨水可吸收少量多余的SO2,发生反应的离子方程式是____________,E装置中使用倒立的漏斗的目的是________________。
(2)装置B用于检验SO2的漂白性,其中所盛试剂为____________________,装置D用于检验SO2的______________性质;
(3)装置C中发生反应的离子方程式为_______________;
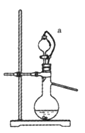
(4)如果用硫酸和亚硫酸钠反应制取二氧化硫,装置如图所示。其中a导管的作用是_______,写出烧瓶中反应的化学方程式 ___________________。
(5)他们拟用以下方法(如图)测定空气中SO2含量(假设空气中无其他还原性气体)。
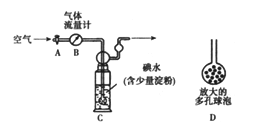
方案1:
① 洗气瓶C中溶液蓝色消失后,若没有及时关闭活塞A,则测得的SO2含量______(填“偏高”、“偏低”或“无影响”)。
方案Ⅱ:
![]()
② 实验中若通过的空气的体积为33.6L(已换算成标准状况),最终所得固体质量为0.233g,试通过计算确定该空气中二氧化硫的体积百分含量____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com