
关于乙烯基乙炔(CH≡C—CH CH2)分子的说法错误的是
CH2)分子的说法错误的是
A.能使酸性KMnO4溶液褪色
B.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2014-2015学年湖北省八校高三二次联考理综化学试卷(解析版) 题型:填空题
(15分)I.已知碳酸锂在水中的溶解度很小且随温度升高而减小,现用Na2CO3溶液和Li2SO4溶液制Li2CO3。
(1)Na2CO3溶液中离子浓度由大到小的顺序为 。
(2)写出制备Li2CO3的化学方程式 。
(3)获得Li2CO3的最佳方法是将反应后的物质 。
a.静置、过滤 b.加热后,趁热过滤 c.蒸发浓缩、冷却结晶
II.可逆反应①A(g)+2B(g)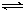 2C(g) ②2E(g)
2C(g) ②2E(g)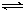 F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
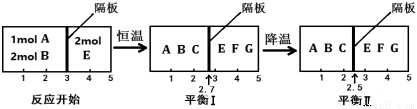
(4)反应①是 反应(填“放热”或“吸热”)。
(5)达到平衡I时,体系压强与反应开始时体系压强之比为 。
(6)平衡I和平衡II中,E的体积分数 (填“相等”、“不相等”、“无法确定”)。
(7)达平衡I时,计算A的转化率 (用分数表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省高一下学期第一次月考化学试卷(解析版) 题型:填空题
填空题 (每空2分,共 18 分)
(1)回答下列变化是哪些能量形式间的转化:
A用蓄电池点亮灯泡 B植物的光合作用 ,C高温分解碳酸钙
(2)书写下列物质电子式 Na2O2
(3)用电子式表示下列物质的形成过程
CaCl2
(4)根据同主族元素性质的相似性和递变性进行预测:(各2分)
①酸性强弱:H3AsO4 H3PO4(用“>”或“<”表示,下同)
②沸点:HF HCl
(5)推测原子序数为34的元素硒(Se)处于元素周期表中 族,关于Se的预测正确的是
A.常温下Se单质是气体
B.Se最高价氧化物的水化物能和NaOH发生反应
C.氢化物的化学式为H2Se
D.常见的氧化物只有SeO3
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是

A.该反应为放热反应
B.该反应为吸热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省高二下学期第一次月考化学试卷(解析版) 题型:填空题
(10分)已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。

实验前 | 实验后 | |
(干燥剂+U形管)的质量 | 101.1g | 102.9g |
(澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省高二下学期第一次月考化学试卷(解析版) 题型:选择题
1mol某烃跟2mol HCl加成生成卤代烷,生成的卤代烷跟Cl2发生取代反应,若卤代烷与Cl2的物质的量之比为1︰10发生完全取代,生成只含二种元素的有机物,则该烃是
A.2-丁烯 B.2-甲基-1,3-丁二烯
C.1-丁炔 D.2-戊烯
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二下学期第一次月考化学试卷(解析版) 题型:选择题
不饱和的脂肪酸是常见的保健食品,DHA(分子式为C22H32O2)是近年来备受关注的一种不饱和脂肪酸(分子中只含有双键而没有环),对大脑的生长发育具有重要的意义,许多海洋生物中含有丰富的DHA。在一个DHA分子中含有碳碳双键数( )个
A.4 B.5 C.6 D.7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:实验题
(15分)二氧化氯( ClO2)是一种极易爆炸的强氧化性气体,在生产和使用时必须尽量用“隋性”气体进行稀释,并尽可能防止震动和避光。因此,二氧化氯的制备方法一直是科学家长期寻求解决的问题,目前比较理想的方法是用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。已知,ClO2在常温下是一种黄绿色有刺激性气味的气体,其熔点为一59℃,沸点为11.0℃,易溶于水。某学生拟用图1所示装置模拟工业制取并收集ClO2.

(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。A装置必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、 。
(2)B装置必须放在冰水浴中,其原因是 。
(3)反应后在装置C中可得NaClO2溶液。已知(1)NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2.3H2O,在温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl;NaClO2的溶解度曲线如图2所示,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;② ;③ ;④低于60℃干燥;得到成品。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:量取ClO2溶液10 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的Ⅺ晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c molL-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32- =2I- +S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30min”,立即进行步骤3,则测定的结果可能(选填“偏大”、“偏小”或“无影响”)。
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g-L一1,(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com