
| A. | ③⑥ | B. | ①② | C. | ③⑤ | D. | ③④⑤⑥ |
分析 A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,核外电子排布相同的离子,核原子序数越大,离子半径越小,所以B离子半径较大.B元素最高化合价等于其最外层电子数,且B元素最高正化合价+|最低负化合价|=8,A元素化合价等于最外层电子数,据此判断B元素与A元素化合价关系,一般来说金属的电负性小于非金属的电负性.
解答 解:A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期.
①A元素形成阳离子与B元素形成阴离子,A元素处于B元素相邻的下一周期,电子层越多,原子半径越大原子半径A>B,故①错误;
②A元素处于B元素相邻的下一周期,原子序数A较大,核外电子排布相同的离子,核原子序数越大,离子半径越小,所以B离子半径较大,即离子半径A<B,故②错误;
③A元素的阳离子与B元素的阴离子具有相同的电子层结构,则离子核外电子数相等,A元素处于B元素相邻的下一周期,原子序数A较大,即原子序数A>B,故③正确;
④金属易失电子,电离能较小,非金属元素不易失电子电离能较大,所以第一电离能:A<B,故④错误;
⑤A元素原子最外层电子数与B元素原子最外层电子数之和为8,则A的正价与B的负价绝对值相等,若A元素原子最外层电子数与B元素原子最外层电子数之和不为8,则A的正价与B的负价绝对值不相等,故⑤错误;
⑥A能形成阳离子,说明A易失去电子,具有较强的金属性,的电负性较弱,B能形成阴离子,说明在反应时易得到电子,具有较强的电负性,则A的电负性小于B的电负性,故⑥正确
所以③⑥正确.
故选A.
点评 本题考查原子的结构与元素的性质,题目难度不大,注意把握原子的结构特点和元素性质之间的关系,注意元素电负性、第一电离能的递变规律,侧重于考查学生对基础知识的应用能力.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
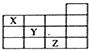
| A. | X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 | |
| B. | 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z | |
| C. | Z的单质常温下是液体,可与铁粉反应 | |
| D. | Z的原子序数比Y大9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的浓度为0.01mol/L | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol/L | |
| C. | 冰醋酸晶体的加入抑制了水的电离 | |
| D. | 该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 作为相对原子质量标准的原子${\;}_{6}^{14}$C | |
| B. | 氯化镁的电子式: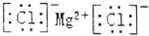 | |
| C. | 用电子式表示氯化氢分子的形成过程: | |
| D. | HClO的结构式为:H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 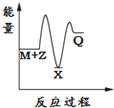 | B. | 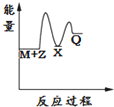 | C. |  | D. |  |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com