
如右图所示,淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银境反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得五元环的酯类化合物E或六元环的酯类化合物F。已知:相关物质被氧化的难易次序是:RCHO最易,R—CH2OH次之,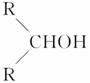 最难。
最难。
请在下列空格中填写A、B、C、D、E、F的结构简式。
A.____________________;B.____________________;
C.____________________;D.____________________;
E.____________________;F.____________________。
解析 首先根据A是淀粉的水解产物及A的氧化产物B、C可确定A为葡萄
糖。葡萄糖分子结构中有三种结构单元:一个—CHO、一个—CH2OH和四个
 ,根据题给信息,—CHO最易被氧化,且B的分子组成(C6H12O7)
,根据题给信息,—CHO最易被氧化,且B的分子组成(C6H12O7)
只比CH2OH(CHOH)4CHO多一个O,所以B是CH2OH(CHOH)4CHO中—CHO
被氧化为—COOH的产物,B的结构简式为:CH2OH(CHOH)4COOH。由C
的分子组成比葡萄糖多两个O,少两个H可判断除醛基外还有一个醇羟基被
氧化,根据题给信息,—CH2OH比 容易被氧化,所以是—CH2OH
容易被氧化,所以是—CH2OH
被氧化为—COOH,C的结构简式为:HOOC(CHOH)4COOH。由D的分子组
成可判断,D是CH2OH(CHOH)4CHO中—CHO被还原为—CH2OH的产物,
D的结构简式为:CH2OH(CHOH)4CH2OH。B中既有—COOH又有—OH,可
以发生分子内酯化反应生成环状化合物,但—COOH与不同的C上的—OH
反应形成的环的大小是不同的,根据E、F是五元环和六元环的酯,可确定E、
F分别是—COOH与4、5位C上—OH酯化的产物(以—COOH上的C为1
位C)。
答案 A.CH2OH(CHOH)4CHO
B.CH2OH(CHOH)4COOH
C.HOOC(CHOH)4COOH
D.CH2OH(CHOH)4CH2OH



科目:高中化学 来源: 题型:
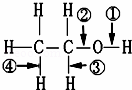
在醇RCH2CH2OH中化学键如图,则下列说法中正确的是( )
|
| A. | 当该醇发生催化氧化时,被破坏的键是②③ |
|
| B. | 当该醇与Na反应时,被破坏的键是① |
|
| C. | 当该醇与羧酸发生酯化反应时,被破坏的键是② |
|
| D. | 当该醇发生消去反应时,被破坏的键是②和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年初,某媒体报道了“皮革奶”事件,不法厂商将皮革下脚料水解后掺入奶粉以提高奶粉中蛋白质的含量。下列说法不正确的是( )。
A.动物皮革的主要成分是蛋白质
B.蛋白质水解的最终产物是氨基酸
C.皮革鞣制过程中使用的K2Cr2O7会使蛋白质盐析
D.利用盐析后可以再溶解的性质可分离提纯蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
近几年一种新型的甜味剂——木糖醇悄悄地走进人们的生活,因为木糖醇是一种理想的蔗糖代替品,它具有甜味足、溶解性好、防龋齿、适合糖尿病患者等优点。木糖醇是一种白色粉末状的固体,结构简式为CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述错误的是 ( )。
A.木糖醇与葡萄糖、果糖等一样是一种单糖
B.木糖醇能与水以任意比互溶
C.木糖醇是一种五元醇
D.木糖醇是一种无糖型植物甜味剂
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是( )
A.Cl2通入NaOH溶液:
Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3溶液中加入稀盐酸:
CO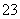 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:
Al3++4NH3·H2O===AlO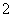 +4NH
+4NH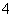 +2H2O
+2H2O
D.Cu溶于稀HNO3:
3Cu+8H++2NO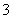 ===3Cu2++2NO↑+4H2O
===3Cu2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。

(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S做沉淀剂,除去废水中的Cu2+和Hg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
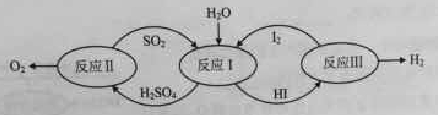
(1)反应Ⅰ的化学方程式是。
(2)反应Ⅰ得到的产物用I2进行分离。该产物的溶液在过量I2的存在下会分成两层——含低浓度I2的H2SO4层和高浓度的I2的HI层。
①根据上述事实,下列说法正确的是(选填序号)。
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
②辨别两层溶液的方法是。
③经检测,H2SO4层中c(H+):c(SO42-)=2.06:1。其比值大于2的原因是。
(3)反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol
它由两步反应组成:i H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol
 ii SO3(g)分解。
ii SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
①X代表的物理量是。
②判断L1、L2的大小关系,并简述理由:。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com