
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.分析 探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
(1)镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大;
探究二:(1)氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置;
(2)装置的气密性、合金是否完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积)等会影响测定结果;
解答 解:探究一:铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(1)含镁为零时,金属铝的含量最高,5.4g合金中铝的质量为5.4g×(1-3%)=5.4×97%g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
5.4g V×10-3L×2.0mol/L
所以54g:5.4g=2mol:(V×10-3L×2.0mol/L),
解得:V=100mL,故V(NaOH溶液)≥100mL;
故答案为:100mL;
(2)镁上会附着偏铝酸钠等物质,未洗涤导致测定的镁的质量偏大,镁的质量分数偏高,
故答案为:偏高;
探究二:(1)由于氯化氢极易溶于水,挥发的氯化氢不影响氢气体积的测定结果,所以不需要加除雾装置,
故答案为:不需要;
(2)反应中装置的气密性、合金是否完全溶解都会影响测定结果,
故答案为:检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案).
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,需要学生具有知识的基础与综合运用知识分析问题、解决问题的能力.


科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X有多种同素异形体,而Y不存在同素异形体 | |
| B. | 由Z与Y组成的物质在熔融时能导电 | |
| C. | 单质的沸点:W<Q | |
| D. | 钠与Y可能形成Na2Y2化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
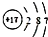 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5d | B. | 6d | C. | 7d | D. | 8d |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
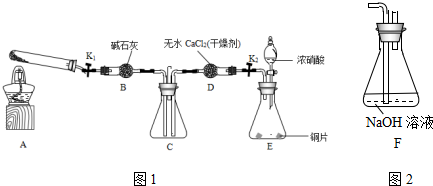
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,1 molN2与足量的氢气反应合成氨,转移的电子数为6 NA | |
| B. | 常温下,1.0LpH=13的氢氧化钡溶液中OH-的数目为0.2NA | |
| C. | 常温常压下,4.6 g的NO2和N2O4混合物中,含原子总数一定为0.3NA | |
| D. | 1L0.1mol/L Na2CO3溶液中含CO32-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质钠与水的反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 醋酸除水垢:2H++CaCO3═Ca2++H2O+CO2↑ | |
| C. | 氢氧化钡溶液和硫酸铜溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 稀硫酸与铁粉反应:Fe+2H+═Fe2++H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com