
| A. | 向某溶液中加入Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则溶液中一定含有SO42- | |
| B. | 氯气和二氧化硫湿润时均有漂白作用,若将二者等物质的量混合溶于水,漂白效果会增强 | |
| C. | 将稀硫酸滴到淀粉碘化钾试纸上,一段时间后变蓝,有反应4H++4I-+O2=2I2+2H2O发生 | |
| D. | 将足量的CO2逐渐通入含等物质的量的Ba(OH)2和KOH的混合溶液中,生成沉淀的物质的量与CO2的关系如图: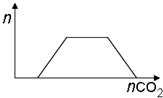 |
分析 A.白色沉淀为硫酸钡,但原溶液中可能含亚硫酸根离子;
B.二者等物质的量反应生成盐酸和硫酸;
C.碘离子被氧化生成碘单质,淀粉遇碘单质变蓝;
D.先发生反应Ba(OH)2+CO2=BaCO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O、CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2.
解答 解:A.白色沉淀为硫酸钡,但原溶液中可能含亚硫酸根离子,则原溶液可能含有SO42-或SO32-,或二者都存在,故A错误;
B.二者等物质的量反应生成盐酸和硫酸,则酸性增强,漂白失效,故B错误;
C.碘离子被氧化生成碘单质,淀粉遇碘单质变蓝,发生4H++4I-+O2=2I2+2H2O,故C正确;
D.先发生反应Ba(OH)2+CO2=BaCO3↓+H2O,将Ba(OH)2消耗完毕,接下来消耗KOH,发生反应2KOH+CO2=K2CO3+H2O、CO32-+CO2+H2O=2HCO3-,最后发生反应BaCO3+CO2+H2O=Ba(HCO3)2,图象应为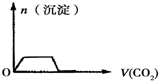 ,故D错误;
,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、离子检验、氧化还原反应等为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.


科目:高中化学 来源: 题型:解答题
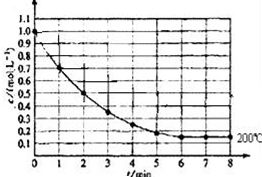 一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.
一固定体积的密闭容器中放入1molX(g)发生反应:X(g)?4Y(s)+Z(g),如图表示在 200℃时,X的浓度随时间变化的曲线.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
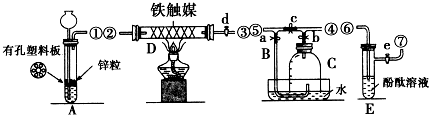
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).
.其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).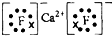 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
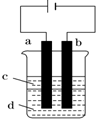 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: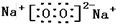 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:
已知两种常见金属A、B分别与两种酸X、Y发生反应各生成三种产物,其转化关系如图所示,其中G溶液呈蓝色.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作及现象 | 溶 液 |
| A | 通入CO2,溶液变浑浊.再升温至65℃以上,溶液变澄清 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加热溶液,又变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
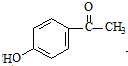
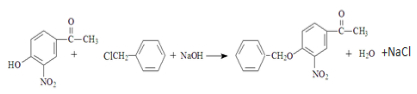
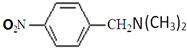
 ③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.
③C的化学式为C15H13NO4,-Bn含苯环但不含甲基.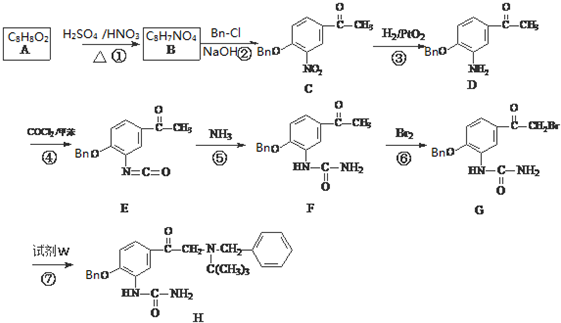
 W
W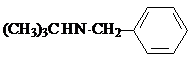 .
. .
. (无机试剂任用)
(无机试剂任用)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
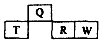 ( )
( )| A. | W的氢化物比R的氢化物稳定 | |
| B. | T的最高价氧化物水化物可能为强碱 | |
| C. | Q的原子半径比T的小 | |
| D. | W和Q的原子序数相差10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com