
【题目】已知二元酸H2A在水中存在以下电离:H2A==H++HA-,HA-![]() H++A2-,回答下列问题:
H++A2-,回答下列问题:
(1)Na2A溶液呈________性,理由是___________(用离子方程式表示)。
(2)NaHA溶液呈________性,理由是___________。
(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=_____________。
(4)某温度下,向10 mL 0.1 mol/L NaHA溶液中加入0.1 mol/L KOH溶液V mL至溶液中水的离子积常数Ka=c2(OH-),此时溶液呈___________性,V____________10 (填“<”“>”或“=”)c(K+)/c(Na+) ____________1(填“<”“>”或“=”),溶液中电荷守恒等式为____________。
【答案】(1)碱;由HA-![]() H++A2-可知,Na2A为强碱弱酸盐(2)酸 ;HA-只电离不水解
H++A2-可知,Na2A为强碱弱酸盐(2)酸 ;HA-只电离不水解
(3)10-5;(4)中;<;<;c(OH-)=c(H+),
Kw=c(OH-)c(H+)=KW=c2(OH-)C(H+)+C(K+)+C(Na+)=C(OH-)+2C(A2-)
【解析】
试题解析:(1)HA-![]() H++A2-为可逆电离,Na2A为弱酸强碱盐溶液,水解显碱性,A2-+H2O=HA-+OH- ;(2)NaHA溶液呈酸性,HA-只能发生电离,不发生水解;(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=C(H+)×C(A2-)/C(HA-)=10-3×10-3/0.1=10-5;(4)中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10; c(K+)/c(Na+) 小于1;溶液中电荷守恒关系为:C(H+)+C(K+)+C(Na+)=C(OH-)+2C(A2-)
H++A2-为可逆电离,Na2A为弱酸强碱盐溶液,水解显碱性,A2-+H2O=HA-+OH- ;(2)NaHA溶液呈酸性,HA-只能发生电离,不发生水解;(3)0.1mol/L的NaHA溶液的PH=3,则Ka(HA-)=C(H+)×C(A2-)/C(HA-)=10-3×10-3/0.1=10-5;(4)中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10; c(K+)/c(Na+) 小于1;溶液中电荷守恒关系为:C(H+)+C(K+)+C(Na+)=C(OH-)+2C(A2-)


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列常见物质的俗名与化学式对应正确的是
A. 小苏打— NaHCO3 B. 铁红— Fe3O4
C. 熟石灰— CaO D. 明矾— CuSO4·5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化可以减少环境污染,而且生成的CO和H2被称作合成气,能合成很多基础有机化工原料。
(1)工业上可利用CO生产乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又知:H2O(l)=H2O(g) ΔH2
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则ΔH与ΔH1、ΔH2、ΔH3之间的关系是ΔH=____________。
(2)一定条件下,H2、CO在体积固定的绝热密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
CH3OCH3(g)+H2O(g),下列选项不能判断该反应达到平衡状态的是__________。
A.v(H2)正=2v(CO)逆 B.平衡常数K不再随时间而变化
C.混合气体的密度保持不变 D.CH3OCH3和H2O的体积之比不随时间而变化
(3)工业可采用CO与H2反应合成再生能源甲醇,反应:CO(g)+2H2(g)![]() CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
CH3OH(g),在一容积可变的密闭容器中充有10 mol CO和20 mol H2,在催化剂作用下发生反应生成甲醇,CO的平衡转化率(α)与温度(T)、压强(p)的关系如图1所示。
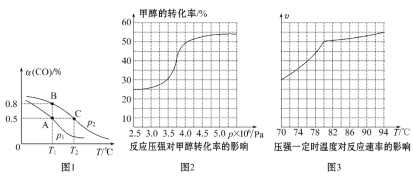
①合成甲醇的反应为______________(填“放热”或“吸热”)反应。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为____________________。p1和p2的大小关系为___________。
③若达到平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积为________L。
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
HCOOCH3(g) ΔH2=-29.1 kJ·mol-1。科研人员对该反应进行了研究,部分研究结果如图2、3:
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是________(填“3.5×106Pa”“4.0×106Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是 ( )
A.Na2CO3是碱
B.Na2CO3是盐
C.Na2CO3是钠盐
D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关二氧化碳的说法错误的是( )
A. 在空气中二氧化碳的体积分数约为0.03%
B. 二氧化碳有毒,不能供人呼吸
C. 过多的二氧化碳排放会导致温室效应
D. 干冰可用于人工降雨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示:
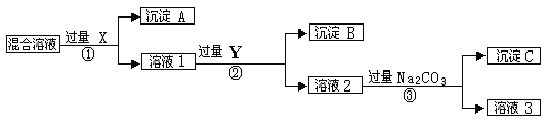
请回答下列问题:
(1)写出实验流程中下列物质的化学式。试剂X : ,沉淀A: ,试剂Y: ,沉淀B: 。
(2)上述实验流程中加入过量的Na2CO3的目的是 。
(3)按此实验方案得到的溶液3中肯定含有 (填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的 ,之后若要获得固体NaNO3需进行的实验操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:
![]()
![]()
![]() 据此反应式判断,下列叙述中不正确的是
据此反应式判断,下列叙述中不正确的是
A. 电池放电时,电池负极周围溶液的PH不断增大
B. 电池放电时,正极的电极反应为:![]()
C. 电池充电时,阳极周围溶液的的PH不断减小
D. 电池充电时,阴极的电极反应为:2![]() +2
+2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO![]() )>c(NH
)>c(NH![]() )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作和数据记录都正确的是
A. 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
B. 用标准NaOH溶液滴定未知浓度盐酸,用去NaOH溶液20.50 mL
C. 用10 mL量筒量取8.25 mL盐酸
D. 用pH试纸测得某溶液pH为3.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com