
| A. | 18gH2O所含电子数为10NA | |
| B. | 常温常压下,48gO3和O2含氧原子数目3NA | |
| C. | 1molNa2O2所含阴离子数目为NA | |
| D. | 11.2L氢气中所含原子数为NA |
分析 A.质量转化为物质的量,1个水分子含有10个电子,据此解答;
B.氧气和臭氧都是由氧原子构成,依据N=$\frac{m}{M}$×NA解答;
C.过氧化钠中阴离子为过氧根子;
D.气体状况未知.
解答 解:A.18gH2O所含电子数为$\frac{18g}{18g/mol}$×10×NA=10NA,故A正确;
B.常温常压下,48gO3和O2含氧原子数目$\frac{48g}{16g/mol}$×NA=3NA,故B正确;
C.过氧化钠中阴离子为过氧根子,1molNa2O2所含阴离子数目为NA,故C正确;
D.气体状况未知,Vm未知,无法计算氢气的物质的量和原子数,故D错误;
故答案为:
点评 本题考查了阿伏伽德罗常数的综合应用,熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间关系是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 冰水混合物 | CuSO4•5H2O | 液态 KNO3 | 蔗糖 |
| B | CaO溶液 | 海水 | 铜 | 酒精 |
| C | 氯气 | 铝合金 | AgCl | CO2 |
| D | 氢氧化钠 | 空气 | Na2SO4溶液 | 食醋 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
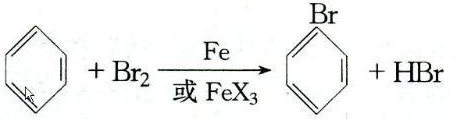 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠密封保存在水中 | |
| B. | 新制的氯水通常保存在无色试剂瓶中 | |
| C. | 氢氧化钠溶液保存在有玻璃塞的玻璃试剂瓶中 | |
| D. | 氢氟酸保存在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
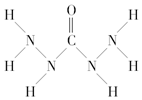
| A. | A中氧元素非金属性最强,故只有氧元素显负价 | |
| B. | 由A中的四种元素组成的化合物可能是离子化合物 | |
| C. | A分子中存在两类共价键 | |
| D. | A分子中氮原子没有孤电子对而氧原子有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
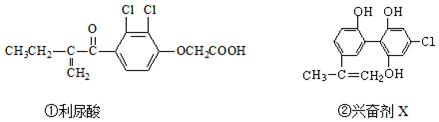
| A. | 利尿酸能发生取代反应、加成反应和酯化反应 | |
| B. | 1mol兴奋剂X与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 可用FeCl3溶液检测利尿酸中是否含有兴奋剂X | |
| D. | 1mol兴奋剂X最多都能和5molNaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
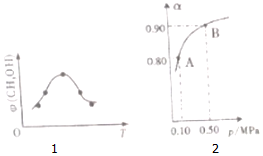 科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H
科学家提出“绿色自由”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为:CO(g)+2H2(g)→CH3OH(g)+H2O(g)△H查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com