反应①Fe(s)+CO
2(g)═FeO(s)+CO(g);△H
1=a kJ?mol
-1,反应②CO(g)+1/2O
2(g)═CO
2(g);△H
2=b kJ?mol
-1测得在不同温度下,在密闭容器中进行的反应①的平衡常数K值随温度的变化如下:
| 温度/℃ |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
(1)反应①的化学平衡常数表达式为
,a
>
>
0(填“>”、“<”或“=”). 在 500℃2L 密闭容器中进行反应①,Fe和CO
2的起始物质的量均为4mol,10min后达到平衡状态,平衡时CO
2的转化率为
50%
50%
,用CO表示的化学反应速率为
0.1mol/(L?min)
0.1mol/(L?min)
.
(2)700℃反应①到平衡,要使该平衡向右移动,其它条件不变时,可以采取的措施有
BC
BC
A.缩小反应器体积 B.通入CO
2 C.升高温度到900℃D.使用合适的催化剂
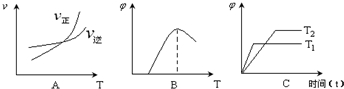
(3)下列图象符合反应①的是
A
A
(填序号)(图中v是速率、φ为混合物中CO的含量,T为温度).
(4)由反应①和②可求得反应2Fe(s)+O
2(g)═2FeO(s)△H
3中的△H
3=
2(a+b)kJ?mol-1
2(a+b)kJ?mol-1
(用含a、b的代数式表示
).
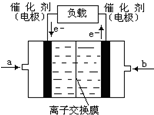
(5)如图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
氧气
氧气
(填“甲醇”或“氧气”),b处电极上发生的电极反应是:
CH3OH-6e-+8OH-═CO32-+6H2O
CH3OH-6e-+8OH-═CO32-+6H2O
.


 ).
).

 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】