
科目:高中化学 来源: 题型:
已知水的电离平衡曲线如图所示,下列说法正确的是 ( )。
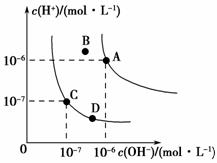
A.水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D)
B.向水中加入醋酸钠固体,可以从C点到D点
C.B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7
D.升高温度可实现由C点到D点
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g) 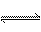 B(g)+C(g)反应的平衡常数和温度的关系如下:
B(g)+C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 900 | 1000 |
| 平衡常数 | 0.4 | 0.9 | 1.0 | 1.6 |
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0,△S 0(填“<”“ >”“ =”)
(2)900℃时,向一个0.5 L的密闭容器中充入6mol的A,如反应初始5s内A的平均反应速率v(A)=0.4 mol·L-1·s-1。则5s时c(A)= mol·L-1, C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 。保持温度和体积不变,再向容器中充入4mol的A,则重新达到平衡时A的转化率为
(3)700℃时反应C(g)+B(g) A(g)的平衡常数的值为
A(g)的平衡常数的值为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
|
| A. | 卤代烃在NaOH存在下水解生成的有机物都是醇 |
|
| B. | 所有的一元醇都能被氧化为具有相同碳原子数的醛或酮 |
|
| C. |
|
|
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于石油的说法不正确的是( )
A.石油中主要含C、H两种元素
B.石油主要是由各种烃组成的混合物
C.石油有固定的沸点,故可分馏
D.石油的分馏产物仍是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
葡萄糖和淀粉的混合物中氢元素的质量分数为6.5%,则混合物中氧元素的质量分数为( )
A.13.0% B.39.0%
C.45.5% D.52.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
在A、B两支大试管中分别依次加入苯、H2O,再用长颈漏斗小心加入CCl4。两试管中都明显分为三层,将A试管振荡后静置(已知苯的密度小于水的密度而四氯化碳的密度大于水的密度)。
(1)溶液可分为________层,原因是________________________________。
(2)不用实验验证你能否判断出哪一层是水层_________,若能,判断的依据是________________________________________________________________________
(若不能,此问可不回答)。
(3)请你设计简单实验验证哪一层是水层: _________________________________
________________________________________________________________________。
(4)用长颈漏斗向B试管中的水层小心加入少量浓溴水,静置一段时间,试管中的现象是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
【实验一】用如图CB31所示装置,收集一量筒甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。
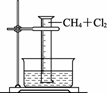
图CB31
(1)该反应的反应类型为______________。
(2)该反应的化学方程式为____________________________________________________
(只写第一步)。
(3)水槽中盛放的液体应为________(填标号)。
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
【实验二】收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)该实验设计的错误之处是_________________________________________________。
【实验三】步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测量溶液的pH(下同),测得pH=3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL蒸馏水,充分振荡,测得pH=1.00。
(5)判断该反应中有氯化氢生成的依据是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知
NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原
因是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com