
| A、AlCl3溶液中加入过量的氨水 |
| B、MgCl2溶液中加入过量的氨水 |
| C、Al2(SO4)3溶液中加入过量的KOH溶液 |
| D、MgSO4溶液中加入过量的KOH溶液 |


科目:高中化学 来源: 题型:
| A、在H2O2分子中含有O22- |
| B、纯H2O2能与水以任意比例混合成H2O2的水溶液 |
| C、H2O2常用作消毒剂 |
| D、在酸性溶液中,H2O2是强氧化剂,还原性较弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Al2(SO4)3溶液中加过量的NaOH溶液可制备Al(OH)3 |
| B、将过量的过氧化钠投入FeCl2溶液中,最终看到白色沉淀 |
| C、用稀硫酸清洗做焰色反应的铁丝 |
| D、镁合金的硬度和强度均高于纯镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
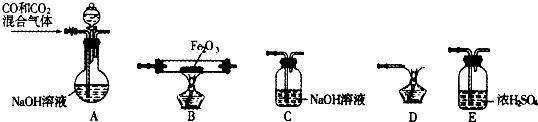
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
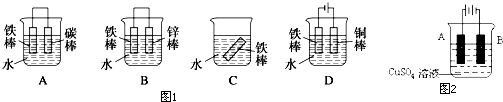
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液呈中性 |
| B、该溶液中:2c(Al3+)+c(Fe2+)+c(H+)=4c(SO42-)+c(OH-) |
| C、在空气中蒸干并灼烧该溶液,最后所得残留固体为氧化铝和氧化铁 |
| D、向该溶液中加入氢氧化钡溶液,当SO42-完全沉淀是,Al3+、Fe2+恰好被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
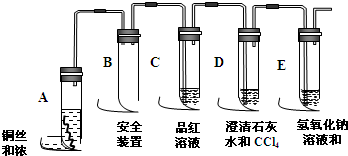
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com