
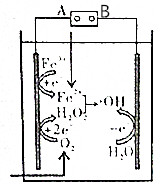
 电-Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+•OH,生成的烃基自由基(•OH)能氧化降解有机污染物.下列说法不正确的是( )
电-Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+•OH,生成的烃基自由基(•OH)能氧化降解有机污染物.下列说法不正确的是( )| A. | 电源的A极是负极 | |
| B. | 电解池中只有O2、Fe3+发生还原反应 | |
| C. | 阳极上发生电极反应:H2O-e-=•OH+H+, | |
| D. | 消耗1molO2,可以产生4mol•OH |
分析 A.电源的A电极连接的电极上发生得电子的还原反应;
B.O2、Fe3+、H2O2均能发生得电子的还原反应;
C.阳极上水失电子生成羟基和氢离子;
D.根据电子守恒分析.
解答 解:A.电源的A电极连接的电极上发生得电子的还原反应,则该电极为阴极,所以A为负极,故A正确;
B.O2、Fe3+在阴极上得电子发生还原反应,H2O2与亚铁离子反应,则H2O2发生得电子的还原反应,故B错误;
C.阳极上水失电子生成羟基和氢离子,其电极方程式为:H2O-e-=•OH+H+,故C正确;
D.1molO2转化为2molH2O2转移2mole-,由Fe2++H2O2=Fe3++OH-+•OH可知,生成2mol•OH,转移2mole-,在阳极上生成2mol•OH,所以消耗1molO2,可以产生4mol•OH,故D正确.
故选B.
点评 本题考查了电解原理的应用、氧化还原反应,题目难度中等,注意把握电解池的工作原理以及电极上发生的反应,根据化合价的变化分析发生的还原反应.


科目:高中化学 来源: 题型:选择题
| A. | 通常用来衡量一个国家的石油化学工业发展水平的标志是石油产量 | |
| B. | 只要存在离子键的化合物就是离子化合物 | |
| C. | NH3的电子式为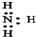 | |
| D. | 原电池中活泼的金属做正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盛有2mL0.1mol/L AgNO3溶液的试管中,先滴加几滴0.1mol/L KCl溶液,再滴加0.1mol/L KI溶液 | 先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 将适量CO2和SO2分别通入装有Ba(NO3)2溶液的两支试管中 | 一支试管出现白色沉淀,另一支试管无明显现象 | 出现的白色沉淀是BaSO3 |
| C | 取少量KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 | 产生白色沉淀 | KClO3中含Cl- |
| D | 湿润的KI淀粉试纸靠近气体Y | 试纸变蓝 | Y可能是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
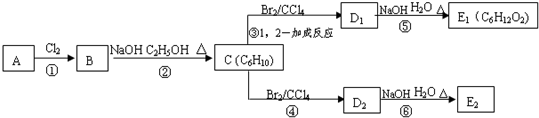
 .
.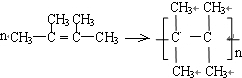 .
.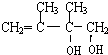 ;C的系统名称是2,3-二甲基-1,3丁二烯.
;C的系统名称是2,3-二甲基-1,3丁二烯. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的少量苯酚可先加适量的溴水,再过滤而除去 | |
| B. | 将苯酚晶体放人少量水中,加热时全部溶解,冷却后形成乳浊液 | |
| C. | 苯酚的酸性很弱,不能使酸碱指示剂变色 | |
| D. | 苯酚有毒,但其稀溶液可直接用作防腐剂和消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64g | B. | 32g | C. | 64g•mol-1 | D. | 32g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 | B. | CaF2 | C. | NO2 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com