
| 1mol×(4-3.6)mol |
| 2mol |
| 1mol×(4-3.6)mol |
| 2mol |
| 92.0kJ×1.6mol |
| 2mol |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
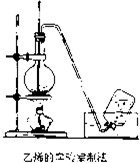 实验室制取乙烯的装置如图所示,请根据图示回答下列问题:
实验室制取乙烯的装置如图所示,请根据图示回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中钙离子数目减小 |
| B、溶液中钙离子浓度减少 |
| C、溶液中氢氧根离子浓度增大 |
| D、pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg、Ag |
| B、Fe、Mg |
| C、Al、Cu |
| D、Mg、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向FeCl3溶液中通入Cl2,然后滴加KSCN溶液 | 验证Cl2的氧化性比Fe3+强 |
| B | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中不一定含有SO42- |
| C | 用洁净的Pt丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中一定含有Na+,一定无K+ |
| D | 直接加热MgCl2?6H2O晶体 | 获取无水MgCl2固体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3 |
| B、相同浓度溶液的碱性:Na2CO3>NaHCO3 |
| C、相同温度下在水中的溶解度:Na2CO3>NaHCO3 |
| D、相同条件下与酸反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将FeCl3稀溶液加热蒸发浓缩制备FeCl3的浓溶液 |
| B、做氢气还原氧化铜的实验是,应先通氢气后加热氧化铜 |
| C、稀释浓硫酸时,应将蒸馏水沿烧杯内壁缓慢地注入浓硫酸中并不断搅拌 |
| D、配制1 mol?L-1350mLNaCl溶液可以选择一个100mL的容量瓶和一个250 mL的容量瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com