
| A. | 0.96 g | B. | 2.88 g | C. | 4.32 g | D. | 5.76 g |
分析 铜粉加入到120mL某浓度的稀硝酸中,充分反应后,容器中剩有mg铜粉,生成Cu(NO3)2和NO气体,根据电子转移守恒计算利用NO计算参加反应的铜的物质的量,再根据铜元素守恒计算溶液中n[Cu(NO3)2],再向溶液中足量稀硫酸至不再反应为止,容器剩有铜粉ng,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,(m-n)为与溶液中NO3-反应的铜的质量,即为加入硫酸后消耗铜粉的质量,以此来解答.
解答 解:收集到标准状况下NO气体336mL,其物质的量为$\frac{0.336L}{22.4L/mol}$=0.015mol,
由电子转移守恒可知,参加反应的铜的物质的量为$\frac{0.015mol×(5-2)}{(2-0)}$=0.0225mol,
由铜元素守恒可知,溶液中n[Cu(NO3)2]=0.0225mol,溶液中n(NO3-)=0.045mol;
再向溶液中足量稀硫酸至不再反应为止,Cu(NO3)2中NO3-发生反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
容器剩有铜粉ng,(m-n)为与溶液中NO3-反应的铜的质量,令再次反应的铜的物质的量为xmol,则:
由反应3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 2
xmol 0.045mol
$\frac{3}{2}=\frac{x}{0.045mol}$,解得x=0.0675mol,
所以再次反应的铜的质量为0.0675mol×64g/mol=4.32g,即加入硫酸后消耗铜粉的质量为4.32g,
故选C.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应及电子守恒为解答的关键,注意守恒法的应用,侧重分析与计算能力的综合考查,题目难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的化合物 | B. | 钠盐 | C. | 可溶于水 | D. | 电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 54 g Al与足量稀硫酸反应,转移的电子数为6 NA | |
| B. | 标准状况下,1.8 g H2O所占的体积约为2.24 L | |
| C. | 物质的量浓度为0.5 mol•L-1的MgCl2溶液中,含有Cl-个数为NA | |
| D. | 1 mol铁与足量的氯气反应,失去的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若起始时投入2mol SO2与1mol O2,则生成2mol SO3 | |
| B. | 若用18O2进行反应,则一段时间后,18O在反应物和生成物中均存在 | |
| C. | t min前,该反应的正反应速率大于逆反应速率 | |
| D. | 平衡时反应物与生成物浓度均不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 粒子 | I2 | Br2 | IO3- |
| 物质的量/mol | 0.5 | 1.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
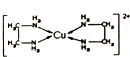 CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),其结构如图所示.则配离子[Cu(En)2]2+的配位数和该微料含有的微料间的作用力类型均正确的是( )
CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),其结构如图所示.则配离子[Cu(En)2]2+的配位数和该微料含有的微料间的作用力类型均正确的是( )| A. | 4,配位键、极性键、非极性键 | B. | 2,极性键、非极性键、氢键 | ||
| C. | 4,离子键、配位键、氢键 | D. | 2,配位键、非极性键、极性键、氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和NaOH溶液 | B. | SO2和NaOH溶液 | C. | NH3和H2O | D. | NO2和H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com