
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A、反应在前5s的平均速率v(A)=0.03mol?L-1?s-1 |
| B、保持其他条件不变,升高温度,平衡时c(A)=0.41mol?L-1,则反应的△H>0 |
| C、相同温度下,起始时向容器中充入2.0mol C,达到平衡时,C的转化率大于80% |
| D、相同温度下,起始时向容器中充入0.40mol A、0.40mol B和0.10mol C,反应达到平衡前v(正)<v(逆) |
| △c |
| △t |
| ||||
|
| ||
| 5s |
| ||||
|


科目:高中化学 来源: 题型:
| A、电解时,石墨作阳极,铁作阴极 |
| B、阴极的电极反应式为:2H++2e-═H2↑ |
| C、电解过程中阳极周围溶液的pH变大 |
| D、理论上每生成1mol KIO3则电路中流过6mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
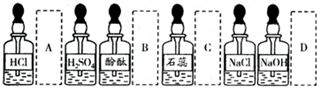
| A、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
| B、浓硫酸沾到皮肤上时,可立即用大量水冲洗,然后涂上3%~5%的NaHCO3溶液 |
| C、酒精灯不慎碰倒起火时,可用湿抹布或沙子盖灭水扑灭,不能用水泼灭 |
| D、碱沾到皮肤上时,应立即用大量水冲洗,再涂上硼酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 3 |
| a |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| 反应时间/min | n(NO2)/mol | n(NH3)/mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.80 | |
| 4 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M |
| B、M2+ |
| C、M3+ |
| D、MO2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
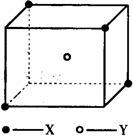 某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:
某离子晶体晶胞结构如图所示,x位于立方体的顶点,Y位于立方体中心.试分析:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2HI(g)?H2(g)+I2(g)△H<0 |
| B、N2(g)+3H2(g)?2NH3(g)△H<0 |
| C、C(s)+H20(g)?C0(g)+H2(g)△H>0 |
| D、2S03?2S0(g)+02(g)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com