
根据反应①~④四个反应,回答下列问题:
①H2S+I2=S+2HI
②2FeCl2+Cl2=2FeCl3
③Cu+2H2SO4(浓)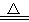 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
④Cl2+2KI=2KCl+I2
(1)反应①的反应类型为(填序号) 。
A.置换反应 B.复分解反应
C.化合反应 D.氧化还原反应
(2)对于反应②,还原剂与氧化剂的物质的量之比为________。
(3)对于反应③,用双线桥法标明电子转移的方向和数目________________________,
(4)写出反应④的离子方程式____ _____________________。
_____________________。
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2016-2017学年江西省宜春市高一上月考二化学卷(解析版) 题型:填空题
焊接钢铁时常用的焊药为氯化 铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是 (写化学式);
(2)写出并配平该反应的化学方程式: ;
(3)反应中2mol的氧化剂能 (填“失去”或“得到”) mol电子。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省饶阳县高一上期中化学试卷(解析版) 题型:实验题
请根据所给装置回答下列问题:
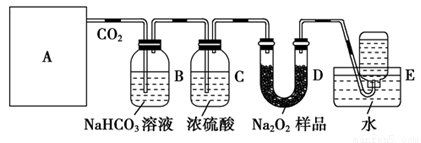
(1)A是制取CO2的装置,最好选用下列装置中的______________ (填序号)。
(2)B装置中发生的离子方程式是_______________________。C装置的作用是_______________________。
(3)D装置中发生反应的化学方程式是_________________。
(4)要想得到较纯净的氧气,可在装置D和E之间增加一盛有________(填写试剂名称)的________(填写装置名称)。
(5)如何检验集气瓶中收集到的气体______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省饶阳县高一上期中化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论正确的是( )
A加盐酸有无色气体产生,该气体能使澄清石灰水变浑浊,原溶液中一定有CO32﹣
B加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42﹣
C某溶液的焰色反应为黄色,则该溶液中一定有Na+
D某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省饶阳县高一上期中化学试卷(解析版) 题型:选择题
下列物质的俗名与其化学式、用途都相符的是(  )
)
A.烧碱、Na2CO3、制玻璃 B.小苏打、NaHCO3、治疗胃酸过多
C.苏打、NaOH、造纸 D.食盐、NaCl、化肥
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
有下列物质,正盐:钾盐、钠盐、铵盐、钡盐;酸:盐酸、硝酸、醋酸、稀硫酸.在水溶液中符合离子方程式:2H++CO32﹣= CO2↑+H2O的化学反应的组合共有( )
A.6个 B.9个 C.12个 D.15个
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一上期中化学卷(解析版) 题型:选择题
下列化学方程式书写正确,且能用离子方程式Ba2++CO32-=BaCO3↓表示的是( )A.Ba(OH)2+CO2=BaCO3↓+H2O
B.Ba(HCO3)+Ba(OH)2=2BaCO3↓+2H2O
C.Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO3
D.Ba(OH)2+2KHCO3=BaCO3↓+KOH+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:选择题
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3 S(g)+O2(g)=SO2(g) △H4
③H2(g)+1/2O2(g)=H2O(l) △H5 2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A.① B.④ C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2017届安徽省培优联盟高三冬季联赛化学试卷(解析版) 题型:填空题
碳、氮及其化合物在工农业生产生活中有着重要作用,请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ • mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若2 molCH4还原NO2至N2,整个过程中放出的热量为1734 kJ,则△H2=_________;
(2)据报道,科学家在一定条件下利用Fe2O3与甲烷反应可制取“纳米级”的金属铁,其反应如下:Fe2O3(s)+3CH4(g)===2Fe(s)+3CO(g)+6H2(g) △H>0
① 若反应在5 L的密闭容器中进行,1 min后达到平衡,测得Fe2O3在反应中质量减少3.2g。则该段时间内CO的平均反应速率为__________mol/(L·s)
② 若该反应在恒温恒压容器中进行,能表明该反应达到平衡状态的是__________(选填序号)
A.CH4的转化率等于CO的产率
B.混合气体的平均相对分子质量不变
c.v(CO)与v(H2)的比值不变
D.固体的总质量不变
③该反应达到平衡时某物理量随温度变化如图所示,当温度由T1升高到T2时,平衡常数KA________KB(填“>”、“<”或“=”),纵坐标表示的物理量可能是__________(填字母)。

A.H2的逆反应速率
B.CH4的的体枳分数
C.混合气体的平均相对分子质量
D.CO的体积分数
(3)而一些科学家采用高质子导电性的SCY陶瓷(能传递H+)实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为N2+3H2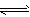 2NH3,该过程中还原反应的方程式为________________。
2NH3,该过程中还原反应的方程式为________________。
(4)若往20 mL0.01mol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法正确的是_____________(填标号)
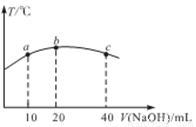
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)> c(NO2-) >c(OH-)> c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com