
| 时间/s | 20 | 40 | 60 | 80 | 100 |
| c(NO2 )/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
分析 (1)根据v=$\frac{△c}{△t}$计算出20s内用二氧化氮表示的平均反应速率v(NO2);
(2)只有二氧化氮有色气体,N2O4为无色,升温后平衡向着生成二氧化氮的方向移动,结合温度对化学平衡的影响分析;
(3)根据表中数据可知80s开始已经达到平衡状态,利用三段式列式计算出平衡时二者的浓度,然后利用平衡常数的表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$计算;
(4)相同温度下,若开始时向该容器中充入的是0.20molN2O4和0.40molNO2,相当于加入了0.40mol N2O4,两个平衡互为等效平衡,则两个反应达到平衡时中二氧化氮的浓度相等.
解答 解:(1)20s时NO2的浓度为0.12mol/L,则20s内用二氧化氮表示的平均反应速率v(NO2)=$\frac{0.12mol/L}{20s}$=0.006mol•L-1•s-1,
故答案为:0.006;
(2)升高温度时,气体颜色加深,说明升温后平衡向着正向移动,则正反应为吸热反应,
故答案为:吸热;
(3)根据表中数据可知,80s后二氧化氮的浓度不再变化,则80s开始已经达到平衡状态,初始时N2O4的浓度为:c(N2O4)=$\frac{0.40mol}{2L}$=0.20mol/L,
N2O4(g)?2NO2(g)
开始0.20mol/L 0
转化 0.15mol/L 0.30mol/L
平衡 0.05mol/L 0.3mol/L
该反应在该温度下的平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.3{0}^{2}}{0.05}$=1.8,
故答案为:1.8;
(4)容器容积不变,在相同温度下,若开始时向该容器中充入的是0.20molN2O4和0.40molNO2,相当于加入了0.40mol N2O4,与原平衡互为等效平衡,所以达到平衡时二氧化氮浓度与原平衡时二氧化氮的浓度相等,都是0.30mol/L,
故答案为:0.30 mol/L.
点评 本题考查了化学平衡的计算,题目难度中等,涉及化学反应速计算、反应热判断、化学平衡常数的计算、等效平衡等知识,明确三段式在化学平衡计算中的应用方法为解答关键,注意掌握相关概念及表达式,试题培养了学生的化学计算能力.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:填空题
 | X | Y | Z | Q |
| 起始(mol) | 0.7 | 1 | ||
| 2min末(mol) | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末(mol) | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )
硫酸生产中炉气转化反应为:2SO2(g)+O2(g)?2SO3(g).研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线I所示.下列判断正确的是( )| A. | 该反应在高温时比低温更易自发进行 | |
| B. | 曲线I上A、C两点反应速率的关系是:vA<vC | |
| C. | T0时该反应的平衡常数为160 | |
| D. | 已知V2O5的催化效果比Fe2O3好,若I表示用V2O5催化剂的曲线,则II是Fe2O3作催化剂的曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 90% | B. | 80% | C. | 45% | D. | 10% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 | |
| B. | 反应放出的热量为0.04 a kJ | |
| C. | 平衡时H2O的转化率为40% | |
| D. | 若将容器的体积压缩为1 L,有利于该反应平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 托盘天平称取NaCl的质量 | 应选用容量瓶的规格(可供选择的规格100mL、250mL、500mL) | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 3:2 | C. | 2:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
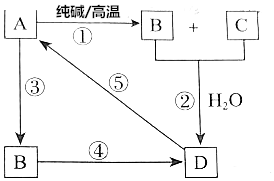 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com