
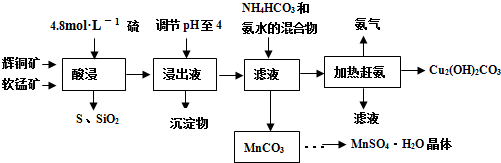
辉铜矿主要成分Cu2S,软锰矿主要成分MnO2,它们都含有少量SiO2、Fe2O3等杂质。工业上综合利用这两种矿物制备硫酸锰和碱式碳酸铜的主要工艺流程如下:

已知:①MnO2能将金属硫化物中的硫氧化为单质硫;
②[Cu(NH3)4]SO4常温稳定,在热水中会分解生成NH3;
③部分金属阳离子生成氢氧化物沉淀 的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.1 |
3.2 |
|
Mn2+ |
8.3 |
9.8 |
|
Cu2+ |
4.4 |
6.4 |
(1)酸浸时,为了提高浸取率可采取的措施有 (任写一点)。
(2)酸浸时,得到的浸出液中主要含有CuSO4、MnSO4等。
写出该反应的化学方程式 。
(3)调节浸出液pH的范围为 ,其目的是 。
(4)本工艺中可循环使用的物质是 (写化学式)。
(5)在该工艺的“加热驱氨”环节,若加热的温度过低或过高,都将造成 的结果。
(6)用标准BaCl2溶液测定样品中MnSO4·H2O质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其可能原因有 (任写一种)。
(1)粉碎矿石或适当升高温度或搅拌(其它合理答案也得分)
(2)Cu2S + 2 MnO2 +4 H2SO4=2CuSO4 + 2 MnSO4 + S↓ + 4H2O
(3)3.2≤pH<4.4 或 [3.2,4.4) [若3.2<pH<4.4或(3.2,4.4)给1分]
使Fe3+转化为Fe(OH)3沉淀而除去
(4)NH3(多写CO2不扣分,不写NH3给 0 分)
(5)碱式碳酸铜产量减少
(6)混有硫酸盐杂质或部分晶体失去结晶水
【解析】
试题分析: 本流程是通过辉铜矿和软锰矿在酸性条件下反应经过一系列条件的控制除去杂质等得到硫酸锰和碱式碳酸铜。
(1)固体反应时一般要粉碎成粉末或小颗粒,加快反应速率,提高浸取率,还可以适当升高温度、搅拌等达到同样的效果。
(3)根据流程调pH后得到的是锰和铜的盐溶液,所以该步是为了除去Fe3+等杂质,但不能让Cu2+和Mn2+沉淀,故pH的范围为3.2≤pH<4.4;
(4)循环使用的物质是在流程中既有生成又做反应物的物质,如NH3;
(5)温度过低,[Cu(NH3)4]SO4分解不完全,温度过高,会导致Cu2(OH)2CO3分解,这两种情况均会使碱式碳酸铜产量减少;
(6)BaCl2溶液测定样品中MnSO4·H2O质量分数是测定样品中SO42-的量,测定时样品纯度大于100%的因素是SO42-的含量偏高了。造成这种原因可能有混有硫酸盐(相对分子质量小于MnSO4)杂质或部分晶体失去结晶水。
考点:考查工业流程中各种条件的控制,定量和定性的分析等内容。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:安徽省怀宁中学2012届高三第四次月考化学试题 题型:022
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强;利用Fe2(SO4)3作氧化剂溶解辉铜矿石(主要成分Cu2S),然后加入铁屑进一步得到铜,其流程如图:
(1)黄铁矿氧化过程的化学反应方程式为________.
(2)完成溶解辉铜矿石(Cu2S)和进一步得到铜的离子反应方程式:
①________Cu2S+________Fe3++________H2O![]() ________Cu2++________Fe2++________( )+________SO42-
________Cu2++________Fe2++________( )+________SO42-
②________.
(3)工业上以辉铜矿为原料,采取火法熔炼工艺生产铜.该过程中有如下反应:
2Cu2S(s)+3O2(g)![]() 2Cu2O(s)+2SO2(g) ΔH=m kJ/mol
2Cu2O(s)+2SO2(g) ΔH=m kJ/mol
2Cu2O(s)+Cu2S(s)![]() 6Cu(s)+SO2(g) ΔH=n kJ/mol
6Cu(s)+SO2(g) ΔH=n kJ/mol
则Cu2S(s)+O2(g)![]() 2Cu(s)+SO2(g) ΔH=________;
2Cu(s)+SO2(g) ΔH=________;
该工艺炼铜的副产品SO2用于制硫酸,SO2转化为SO3的反应为:2SO2(g)+O2(g)![]() 2SO3(g),该反应的平衡常数表达式为K=________.
2SO3(g),该反应的平衡常数表达式为K=________.
(4)请评价细菌冶金的优点________(说一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:安徽省月考题 题型:填空题

 ___Cu2++___Fe2++______+___SO42-
___Cu2++___Fe2++______+___SO42- 2SO3(g),该反应的平衡常数表达式为K=_______
2SO3(g),该反应的平衡常数表达式为K=_______查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com