
| A. | S(s)+O2(g)═SO2(g)△H=△H2-△H1 | |
| B. | S(s)+O2(g)═SO2(g)△H=△H1-△H2 | |
| C. | S(s)+O2(g)═SO2(g)△H=△H2+△H1 | |
| D. | 1molS(s)燃烧生成1molSO2(g)放出的热量大于1molS(g)燃烧生成1molSO2(g)放出的热量 |
分析 S(s)=S(g)△H1,S(g)+O2(g)═SO2(g)△H2,则S(s)燃烧的热化学方程式S(s)+O2(g)═SO2(g)△H=△H1+△H2得到,据此回答计算.
解答 解:S(s)=S(g)△H1,S(g)+O2(g)═SO2(g)△H2,则S(s)燃烧的热化学方程式S(s)+O2(g)═SO2(g)△H=△H1+△H2,因为固体硫转化为气体的过程是吸热的,所以1molS(s)燃烧生成1molSO2(g)放出的热量小于1molS(g)燃烧生成1molSO2(g)放出的热.
故选C.
点评 本题涉及盖斯定律的应用以及燃烧热的大小比较等知识,注意知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内质子数为15的元素的最高正价为+3 | |
| B. | 电子层数相同时,最外层7个电子的元素非金属性最强 | |
| C. | 原子序数从11依次增加到17,原子半径逐渐增大 | |
| D. | 随着原子序数的增加,元素原子最外层电子数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
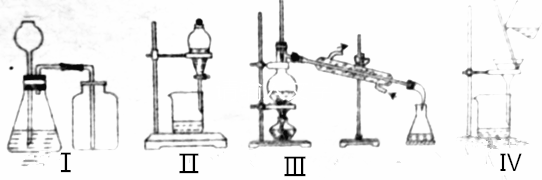
| A. | 选择装置Ⅰ用铜与浓硝酸反应制备NO2 | |
| B. | 选择装置Ⅱ分离乙酸乙酯和饱和碳酸氢钠溶液的混合物 | |
| C. | 选择装置Ⅲ分离对硝酸甲苯和邻硝基甲苯 | |
| D. | 选择装置Ⅳ分离饱和硫代硫酸钠溶液和硫代硫酸钠晶体的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,12gC60和C70的混合物中含有的碳原子数为NA | |
| B. | 22.4L SO2气体中含有的氧原子数为2NA | |
| C. | 1.0L 1.0mol•L-1CH3COOH溶液中含有的CH3COOH分子数为NA | |
| D. | 标准状况下,5.6LCCl4含有的分子数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5mol/(L•min) | B. | υ(B)=1.2mol/(L•s) | C. | υ(C)=1mol/(L•s) | D. | υ(D)=2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
| A. | 反应在前50s的平均速率为v(PCl3)=0.0064mol/(L•s) | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入4molPCl3、4molCl2,达到平衡时,则此反应的化学平衡常数为0.025mol/L | |
| D. | 相同温度下,起始时间向容器中充入2molPCl5、0.40molPCl3和0.40molCl2,达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向逆反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com