
【题目】(1)常温下,有pH值为12的NaOH溶液100 mL,欲将其pH值变为11,采取下列三种措施(设混合后溶液的体积等于两混合溶液体积之和)。请回答有关问题:
①若加水,应加入约________ mL。
②若用pH=10的NaOH溶液,应加入此NaOH溶液________ mL。
③若用pH=2的盐酸,应加入________ mL。
(2)pH=2的HA、HB两种酸溶液各1mL,分别加水稀释到1000mL, 其pH的变化如图所示

①稀释前两溶液的浓度c(HA)________c(HB)(填>.<.=,或无法确定)
② HB _______ 是弱酸 (填“一定”、“可能”或“一定不”)
③若 a = 5,则HA酸是否是强酸 ____(填“一定是”、“可能是”、 “一定不是”或“无法确定”)
④稀释后的溶液中,由水电离产生的c(H+): HA中_____ HB中(填>.<.=,或无法确定)
【答案】900 1000 81.8(或900/11) < 一定 一定是 >
【解析】
(1)①pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,设加入水的体积是V2,c1V1=c2(V1+V2)=0.01mol/L×0.1L=(0.1+V2)L,V2=![]() =0.9L=900mL;
=0.9L=900mL;
②pH=12 的NaOH溶液中氢氧根离子浓度是0.01mol/L,pH=11的氢氧化钠溶液中氢氧根离子浓度是0.001mol/L,pH=10的氢氧化钠溶液中氢氧根离子浓度是0.0001mol/L,设加入pH=10的NaOH溶液体积是V2,
c1V1+c2V2=c3(V1+V2)=0.01mol/L×0.1L+0.0001mol/L×V2=0.001mol/L×(0.1+V2),V2=1L=1000mL;
③pH=2的HCl溶液中氢离子浓度是0.01mol/L,设加入盐酸的体积是V,
c(OH-)=![]() =
=![]() =0.001mol/L,V=81.8mL;
=0.001mol/L,V=81.8mL;
(2)pH相同的酸,稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小。据此得出酸性:HA>HB;①在稀释前两种酸的pH相同,而两种酸的酸性:HA>HB,故在稀释前两种酸溶液的浓度c(HA)<c(HB);②pH相同的酸,稀释相同倍数时,酸性强的酸的pH的变化大,酸性较弱的酸的pH的变化小,故HA的酸性强于HB的酸性,HB一定是弱酸;③ 若 a = 5,则pH=2的HA酸c(H+)=10-2mol/L,稀释1000倍pH=![]() =10-5mol/L,说明该酸溶液中不存在电离平衡,完全电离,一定是强酸;
=10-5mol/L,说明该酸溶液中不存在电离平衡,完全电离,一定是强酸;
④ 稀释后的溶液中HA中氢离子浓度小于HB中氢离子浓度,对水的电离抑制程度较小,则由水电离产生的c(H+) : HA中>HB中。


科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同.已知t3~t4阶段为使用催化剂.下列说法错误的是

A. 若t1=15s,生成物C在 t0~t1时间段的平均反应速率为0.004 molL﹣1s﹣1
B. t4~t5阶段改变的条件为减小压强,t5~t6阶段改变的条件是升高化学反应的温度
C. B的起始物质的量为0.02 mol
D. 该化学反应的表达式为:3A(g)B(g)+2C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O。

(1)甲池是______装置;
(2)乙池中A(石墨)电极的名称是______;
(3)写出通入CH3OH的电极的电极反应式:______;
(4)乙池中反应的化学方程式为______;
(5)当乙池中B(Ag)极的质量增加4.32g时,此时丙池某电极上析出1.60g某金属,则丙池中的某盐溶液可能是 ______(填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组用如下装置制备三氯化铁,并探究SO2与三氯化铁反应的产物。

(1)以上A—F装置中需要加热的有___________(用字母表示)。
(2)F中碱石灰的作用是_________________________________。
(3)反应一段时间后熄灭酒精灯,关闭装置中的两个止水夹,冷却至室温。若将收集器中的三氯化铁配制成溶液,分液漏斗中的X物质是___________,操作过程为___________。
(4)将G中产生的二氧化硫气体通入到收集器的三氯化铁溶液中,取反应后的溶液进行如下实验:
实验I:向溶液中加入BaCl2溶液,出现白色沉淀,说明溶液中含有的离子是___________,产生这种离子的离子方程式为_________________________________。
实验II:取少量液体于试管中,用一束光照射液体,有一条光亮的通路,试用离子方程式解释以上现象:_________________________________。
(5)取少量D中反应后剩余固体于小烧杯中,再加入稀盐酸将固体溶解,向所得溶液中滴入几滴KSCN溶液,溶液未变红色,___________(填“能”或“不能”)说明D中无FeCl3,用离子方程式解释______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,把0.5mol/L的HF溶液加水稀释,随着加水量的增大,下列判断正确的是
A. 溶液中F-的个数减小 B. 电离平衡常数ka值变大
C. 电离转化率不变 D. c(F- )/c(HF)此比值增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
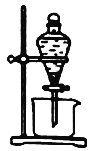
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
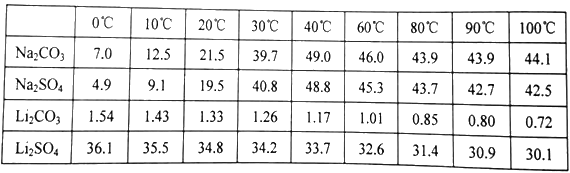
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列填空:
(1)漂白粉溶液在空气中放置失效,发生反应的离子方程式:_______________________。
(2)次氯酸的电离方程式:______________________________________。
(3)氯化铁溶液与单质铜反应的化学方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修5:有机化学基础)
我国科学家在合成、生产生物医用材料——新型增塑剂(DEHCH)方面获得重要进展,该增塑剂可由有机物D和L制备,其结构简式如下:

(1)有机物D的一种合成路线如下:

已知:
(R、R表示烃基或氢)
①由C2H4生成A的化学方程式是________。
②试剂a是________
③写出B中所含官能团的名称________。
④有机物D的结构简式是________。
(2)增塑剂(DEHCH)的合成路线如下:
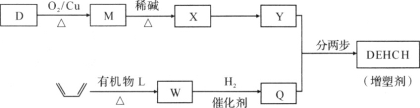
已知:
⑤D→M的化学方程式是________。
⑥有机物L的分子式为C4H2O3,核磁共振氢谱显示只有一种化学环境的氢原子。W的结构简式是________。
⑦以Y和Q为原料合成DEHCH分为两步反应,写出有关化合物的结构简式:

中间产物的结构简式是________,反应a的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载,小米“健脾、和胃、安眠”,这主要是某种氨基酸的作用。下列有机物水解能生成氨基酸的是( )
A.蔗糖B.蛋白质C.油脂D.纤维素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com