
| A. | 两原子N层上都有1个s电子,一个原子无d电子,另一个原子有d电子 | |
| B. | 两原子其核外全部都是s电子 | |
| C. | 最外层电子排布为2s22p5的原子和最外层电子排布为2s22p6的离子 | |
| D. | 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子 |
分析 A、原子N层上都有1个s电子,原子无d电子为K原子,原子有d电子为Cr、Cu;
B、两原子的核外全部都是s电子,原子具有1s能级或具有1s、2s能级;
C、最外层电子排布为2s22p5的原子为氟原子,最外层电子排布为2s22p6的离子可能是阴离子也可能是阳离子;
D、原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,不能确定N层是否有电子排布,符合条件的原子为氩原子,钾原子,钙原子.
解答 解:A、原子N层上都有1个s电子,原子无d电子为K原子,原子有d电子为1s22s22p63s23p63d54s1,是Cr原子,1s22s22p63s23p63d104s1,是Cu原子,都处于第四周期,故A正确;
B、两原子的核外全部都是s电子,原子具有1s能级或具有1s、2s能级,不处于同一周期,如氢原子与锂原子,故B错误;
C、最外层电子排布为2s22p5的原子为氟原子,最外层电子排布为2s22p6的离子可能是阴离子也可能是阳离子如O2-、Na+等,故C错误;
D、原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子,符合条件的原子的核外电子排布式有1s22s22p63s23p6为氩原子,1s22s22p63s23p64s1为钾原子,1s22s22p63s23p64s2为钙原子,不一定处于同一周期,故D错误;
故选A.
点评 本题考查核外电子排布规律,难度中等,掌握核外电子排布规律:①、每个轨道最多只能容纳两个电子,且自旋相反配对;②、能量最低原理:电子尽可能占据能量最低的轨道;③、简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子;另外:等价轨道在全充满、半充满或全空的状态是比较稳定的.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
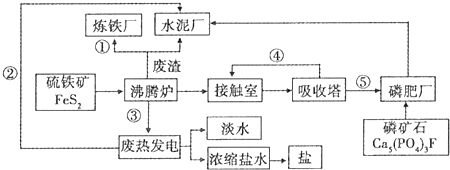
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种清洁能源 | B. | CH4•nH2O是一种离子化合物 | ||
| C. | 可燃冰在常温常压下能稳定存在 | D. | 可燃冰是天然气冷却后得到的固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
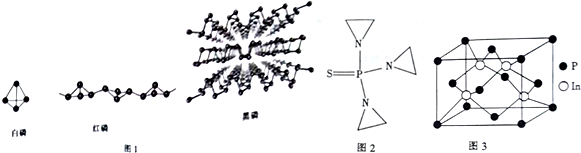
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍的原子失电子能力比镁弱 | |
| B. | Tl(OH)3 和Al(OH)3一样都属于两性氢氧化物 | |
| C. | 硫化氢比硒化氢稳定 | |
| D. | 锂与氧气在点燃的条件下生成氧化锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,离子只有氧化性 | |
| B. | 金属元素的单质在常温下均为金属晶体 | |
| C. | 金属元素在不同的化合物中的化合价均不同 | |
| D. | 金属元素在一般化合物中只显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═CH2+ (过氧乙酸)→ (过氧乙酸)→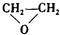 +CH3COOH +CH3COOH | |
| B. | CH2═CH2+Ca(OH)2→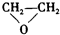 +CaCl2+H2O +CaCl2+H2O | |
| C. | 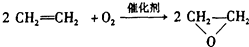 | |
| D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B一定是同分异构体 | B. | A和B不可能是同系物 | ||
| C. | A和B的实验式一定相同 | D. | A和B的化学性质一定相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com