
����Ŀ��1814���ά������һ�Ȼ���(�е�97.4��)����һ�ֺ���ɫ�ӷ�Һ�壬����������±�����ƣ�������ǿ�������������������ⷴӦ�����Ʊ�ICl ����������װ�����Ʊ�ICl��

�ش�����������
��1���Ʊ�IClʱ����װ�ýӿڵ�����˳����__________��
��2���ܷ�װ��B �еı���ʳ��ˮ����ˮ______(������������������)������ƽ���ƶ��Ĺ۵����������________________��
��3��Dװ���е���ƿ�������ˮ�У���Ŀ����____________��
��4����Dװ�õõ���Һ̬��������ᴿ�ɵõ��ϴ�����IC1,�ᴿ��ȡ�ķ�����___________��
��5��ICl �����NaOHϡ��Һ��Ӧ�����ӷ���ʽΪ______________��
��6�������ʵ��֤��IC1�������Ա�I2ǿ��________________��
���𰸡� acbghefd ���� ��Ϊ����Ҫ��ˮ��Ӧ:Cl2+H2O![]() HCl+HClO,����ʳ��ˮ��������Ũ�ȴ�ʹ������ˮ��Ӧ��ƽ�����ƣ�������������ˮ ��ֹIC1�ӷ�(�𰸺�������) ���� IC1+2OH-=IO-+Cl-+H2O ��ʪ���KIһ������ֽ����IC1��������ֽ����
HCl+HClO,����ʳ��ˮ��������Ũ�ȴ�ʹ������ˮ��Ӧ��ƽ�����ƣ�������������ˮ ��ֹIC1�ӷ�(�𰸺�������) ���� IC1+2OH-=IO-+Cl-+H2O ��ʪ���KIһ������ֽ����IC1��������ֽ����
������������������������֪����װ�ð�������˳���������������Ϊ��Aװ�������Ʊ�������Bװ�����ڳ�ȥ�����е��Ȼ��⣬Eװ�����ڸ���������Dװ���Ǹ����������ⷴӦ�ķ�Ӧ����Cװ������β��������
��1���Ʊ�IClʱ����װ�ýӿڵ�����˳����acbghefd��
��2������������ˮ��������ˮ��Ӧ��Cl2+H2O![]() HCl+HClO������ʳ��ˮ��������Ũ�ȴ�ʹ������ˮ��Ӧ��ƽ�����ƣ�������������ˮ���������ڱ���ʳ��ˮ���ܽ�Ƚ�С�����Բ��ܽ�װ��B�еı���ʳ��ˮ����ˮ��
HCl+HClO������ʳ��ˮ��������Ũ�ȴ�ʹ������ˮ��Ӧ��ƽ�����ƣ�������������ˮ���������ڱ���ʳ��ˮ���ܽ�Ƚ�С�����Բ��ܽ�װ��B�еı���ʳ��ˮ����ˮ��
��3��Dװ���е���ƿ�������ˮ�У���Ŀ���Ƿ�ֹIC1�ӷ���
��4����Dװ�õõ���Һ̬��������ᴿ�ɵõ��ϴ�����IC1�����Ը����Ȼ���ķе����������ϴ���з��룬���ᴿ�Ȼ����ȡ�ķ�����������
��5��������������NaOHϡ��Һ��Ӧ��ICl�����NaOHϡ��Һ��Ӧ�����ӷ���ʽΪIC1+2OH-=IO-+Cl-+H2O��
��6����ȼ��������ķ�������ʪ���KIһ������ֽ����IC1��������ֽ��������֤��IC1�������Ա�I2ǿ��


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������˵������ȷ���ǣ� ��
A.���³�ѹ�£�22.4 L��ϩ�к�C��H������ĿΪ4NA
B.1molFe���������ᷴӦת�Ƶ�����Ϊ3NA
C.1.6g�������ͳ�����ɵĻ�����к��е���ԭ����ĿΪ0.1NA
D.��1L 1 molL��1�Ȼ�����Һ�м��������İ�ˮ������AlO2���ĸ���ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)���㽫��ӦCu+2FeCl3==CuCl2+2FeCl2��Ƴ�ԭ��ز��ش���������:
��д���缫��Ӧʽ:����_____________________������_________________________��
�ڻ���������Ƶ�ԭ��ؼ���װ��ͼ_________��
(2)�õ�������ṩ0.2mol ���ӣ��������ϵ������仯Ϊ________________________��
(3)���÷�Ӧ2Cu+O2+2H2SO4==2CuSO4+2H2O���Ʊ�CuSO4�������÷�Ӧ���Ϊԭ��أ��������ķ�ӦʽΪ____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ����
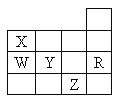
A. ���³�ѹ������Ԫ�صĵ�����Z���ʵķе����
B. Y��Z�������ӵ��Ӳ�ṹ����Rԭ����ͬ
C. W���⻯������ȶ��Ա�X���⻯������ȶ��Ը�
D. YԪ�صķǽ����Ա�WԪ�صķǽ�����ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ���
A�����ֽⷴӦ���е���������ԭ��Ӧ���еIJ���������ԭ��Ӧ
B���û���Ӧ�п����Ƿ�������ԭ��Ӧ
C�����Ϸ�Ӧһ����������ԭ��Ӧ
D���ֽⷴӦ��һ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ�ܵ���,���䱾�����ڷǵ���ʵ��ǣ� ��
A. Һ�� B. �ɱ� C. �ƾ� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��������������Z��Һ�й�����ͼ��װ�ã�ʵ���е�����ָ�뷢��ƫת��ͬʱX����֣�Y����ϸ����X��Y��Z�����������еģ� ��
��� | X | Y | Z |
A | Zn | Cu | ϡ���� |
B | Cu | Zn | ϡ���� |
C | Cu | Ag | ����ͭ��Һ |
D | Ag | Zn | ��������Һ |

A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ԫ�ص�����aA3+��bB+��cC2-��dD- ��������ͬ�ĵ��Ӳ�ṹ ,��������������ȷ���ǡ�(�� ��)
A. ԭ�Ӱ뾶:A>B>D>C B. ԭ������:d>c>b>a
C. ���Ӱ뾶:C>D>B>A D. ���ʵĻ�ԭ��:A>B>D>C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�����÷�ͭм�������ʣ��Ʊ�����������ͭ���壩�Ĺ��� 
��֪��
��Һ�б����������� | Fe3+ | Fe2+ | Cu2+ |
��ȫ������������ij���ʱ����Һ��pH | ��3.7 | ��6.4 | ��4.4 |
��ش�
��1��������������������������X���� ������ĸ����
A.NaClO
B.H2O2
C.KMnO4
��2�������Լ�����Ϊ�˵���pH���Լ��ٿ���ѡ�����ѧʽ����
��3�������ٵ������� ��
��4������D����������Եõ�FeCl3��Һ������FeCl3��Һ��������˵������ȷ���� ��
A.��FeCl3������Һ��μ����ˮ�У����������ȵõ����ɫҺ�壬��Һ���ܲ��������ЧӦ
B.��FeCl3��Һ�μ�NaOH��Һ�����ֺ��ɫ����
C.��FeCl3��Һ�μ�NaOH��Һ���������������գ��õ�Fe��OH��3����
D.��FeCl3��Һ�еμ�KSCN��Һ����Һ��Ϊ��ɫ
��5������D������������ۣ������Ƶ�FeCl2��Һ��ʵ���ұ���FeCl2��Һ���������������۷�ֹFeCl2��Һ���ʣ���ԭ�����������ӷ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com