
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
D.正极上发生的反应为O2+4e-+2H2O===4OH-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有一种有机物的结构简式为:
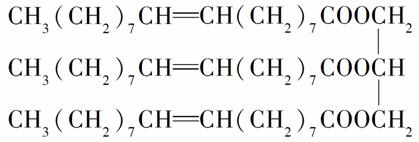
试回答下列问题:
(1)该化合物是________(填选项字母,下同)。
A.烯烃 B.油脂
C.蛋白质 D.糖类
(2)该化合物的密度________。
A.比水大 B.比水小
C.与水相同
(3)常温下该化合物呈________。
A.液态 B.固态
C.气态
(4)下列物质中,能与该物质反应的有________。
A.NaOH(aq) B.溴水
C.乙醇 D.乙酸
E.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下列氧化还原反应,指出氧化剂和还原剂,氧化产物和还原产物。
(1)CuO+CO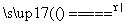 Cu+CO2
Cu+CO2
氧化剂:________,还原剂:________,氧化产物:________,还原产物:________。
(2)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
氧化剂:________,还原剂:________,氧化产物:________,还原产物:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可以采用如图所示装置来测定某种氨基酸的分子式。取w g该种氨基酸样品,放在纯氧中充分燃烧,生成CO2、H2O和N2。请回答有关问题:
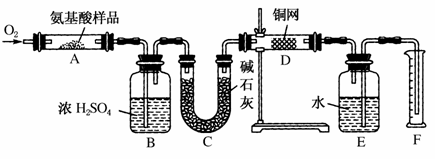
(1)E装置的作用是________________________________________________________________________。
(2)需要加热的装置是________(填字母代号)。
(3)装置D的作用是________________________________________________________________________。
(4)F处读数时应该注意:________________________________________________________________________,________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A.若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B.由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C.反应①②转移的电子数相同
D.反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列热化学方程式:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ·mol-1
③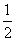 H2SO4(l)+NaOH(l)===
H2SO4(l)+NaOH(l)===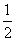 Na2SO4(l)+H2O(l)
Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ·mol-1
④C(s)+O2(g)===CO2(g)
ΔH=-393.5 kJ·mol-1
⑤CO(g)+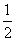 O2(g)===CO2(g)
O2(g)===CO2(g)
ΔH=-283 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)===2H2O(l)
ΔH=-517.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有_________________________________________,
不正确的理由分别是____________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:
________________________________________________________________________。
(3)上述反应中,表示标准燃烧热的热化学方程式有________________________________;
表示中和热的热化学方程式有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应:2SO2(g)+O2(g)2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.增大压强 B.升高温度
C.使用催化剂 D.多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积固定的V L密闭容器中加入n mol A、2n mol B,发生反应:A(g)+2B(g)2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A、B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=__________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。
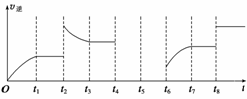
①由图可知,反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的条件:
t2时________________________________________________________________________;
t8时________________________________________________________________________。
②t2时平衡向______(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线。
查看答案和解析>>
科目:高中化学 来源: 题型:
进行下面的实验要用到下列一种或几种仪器,请用这些仪器的名称填空。
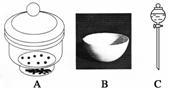
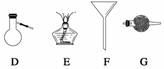
(1)欲干燥NH3需使用仪器________________________________________________;
(2)欲分离互不相溶的两种液体,可使用____________________________________;
(3)欲分离液态混合物中沸点不同的组分,可使用_____________________________;
(4)欲分离悬浮于液体中的固体物质,可使用_________________________________;
(5)欲用胆矾晶体(CuSO4·5H2O)制无水硫酸铜固体,可使用:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com