
【题目】下表是元素周期表的一部分,按要求填空![]() 填元素符号或化学式
填元素符号或化学式![]() :
:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
![]() 写出下列元素的元素符号:①______②____________
写出下列元素的元素符号:①______②____________
![]() 在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
![]() 在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______.
在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______.
![]() 在③与④的单质中,化学性质较活泼的是______,判断依据是______;在⑧与的单质中,化学性质较为活泼的是______,判断依据是______.
在③与④的单质中,化学性质较活泼的是______,判断依据是______;在⑧与的单质中,化学性质较为活泼的是______,判断依据是______.
【答案】N F Ca K F Ar HClO4 KOH Al(OH)3 Na Na元素的金属性比Mg强 Cl2 氯元素的非金属性比溴强
【解析】
根据元素在元素周期表中的位置,可写出①~分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br,然后根据元素周期律和元素化合物的性质答题即可。
(1)①②的元素符号分别为N、F、Ca;
(2)根据元素周期律我们可知,最活泼的金属元素应在周期表的左下角,最活泼的非金属元素应在周期表的右上角(除去稀有气体),最不活泼的元素应是稀有气体,故在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar;
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物应该在金属非金属的分界线上,是Al(OH)3;
(4)③与④为同周期主族金属元素,故Na元素的金属性比Mg强,所以单质较为活泼的是Na,⑧与为同主族非金属元素,故氯元素的非金属性比溴强,所以单质较为活泼的是氯气。


 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
化学键 | H—H | C—O | C←=O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________(填曲线标记字母),其判断理由是___________________________________________________。
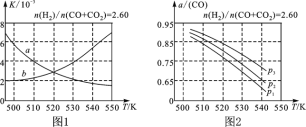
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________(填“增大”或“减小”),其原因是______________________________________________________。图2中的压强由大到小为__________,其判断理由是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)=2H2O(l) ΔH=-569.6kJ/mol,2H2O(g)=2H2(g)+O2(g) ΔH=+482.1 kJ/mol。现有1g液态H2O,蒸发时吸收的热量是 ( )
A. 2.43 kJ B. 4.86 kJ C. 43.8 kJ D. 87.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐、蔗糖、醋酸、84消毒液(主要成分为NaClO)、洁厕灵(主要成分为盐酸)等是灾后经常使用的物质,下列有关说法或化学用语正确的是
A. 食盐中阴离子的结构示意图:![]()
B. 蔗糖和醋酸都是弱电解质
C. 84消毒液显碱性的原因:ClO-+H2O![]() HClO+OH-
HClO+OH-
D. 84消毒液和洁厕灵不能混用的主要原因是发生酸碱中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水的母液中提取金属镁的一种工艺流程如下:

下列说法不正确的是
A. 步骤①沉镁可加入石灰乳
B. 步骤③脱水时,在空气中加热MgCl2·6H2O得到MgCl2
C. 步骤④中镁在阴极生成
D. 设计步骤①、②、③的主要目的是富集镁元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于氧化还原反应,且为吸热反应的是 ( )
A.C+H2O![]() CO+H2B.2NaOH+H2SO4=Na2SO4+2H2O
CO+H2B.2NaOH+H2SO4=Na2SO4+2H2O
C.Zn+2H+=Zn2++H2↑D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
2CO(g)+2H2(g) ΔH>0,有利于提高CH4平衡转化率的条件是
A. 高温低压 B. 低温高压 C. 高温高压 D. 低温低压
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
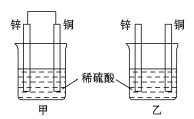
(1)下列说法中正确的是________(填序号)。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中H+的浓度均减小
(2)在相同时间内,两烧杯中产生气泡的速率:甲________(填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为 _________(正极/负极),写出铜极的电极方程式___________
(4)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com