
| A. | 稀硫酸滴到铁片上:Fe+H+═Fe2++H2↑ | |
| B. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+2OH-═Cu(OH)2↓ | |
| C. | 碳酸钠溶液与稀盐酸反应:CO32-+2H+═H2CO3 | |
| D. | 碳酸氢钠溶液与盐酸混合:HCO3-+H+═H2O+CO2↑ |
分析 A.该离子方程式两边氢元素质量不守恒,正电荷不相等,违反了质量守恒、电荷守恒;
B.硫酸铜为易溶的强电解质,离子方程式中硫酸铜应该拆开;
C.碳酸钠与稀盐酸反应生成氯化钠、二氧化碳气体和水,碳酸应该拆开,写成二氧化碳和水的形式;
D.碳酸氢钠与盐酸反应生成氯化钠、二氧化碳气体和水.
解答 解:A.稀硫酸滴到铁片上生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.硫酸铜与氢氧化钠溶液反应生成硫酸钠和氢氧化铜,正确的离子方程式为:Cu2++2OH-═Cu(OH)2↓,故B错误;
C.碳酸钠溶液与稀盐酸反应生成二氧化碳气体和水,正确的离子方程式为:CO32-+2H+═H2O+CO2↑,故C错误;
D.碳酸氢钠溶液与盐酸反应生成氯化钠、二氧化碳气体和水,反应的离子方程式为:HCO3-+H+═H2O+CO2↑,故D正确;
故选D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
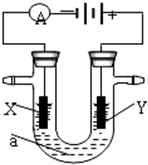 变”)
变”)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1>Q3>Q2 | B. | Q3>Q2>2Q1 | C. | Q2>Q3>2Q1 | D. | Q3>2Q1>Q2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
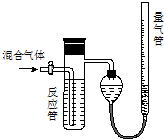
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 | 原理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离氯化钠和碘的固体混合物 | 加热法 | 碘单质易升华 |
| C | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
| D | 除去NaOH溶液中的Na2SO4 | 加适量的BaCl2后过滤 | BaSO4难溶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 回答下列问题:
回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com