
| A. | X- | B. | 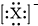 | C. | 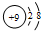 | D. |  |
分析 A.X-表示带有1个单位负电荷的离子,可能为氯离子、溴离子,不一定为氟离子;
B.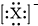 为带有1个负电荷的阴离子,可能为溴离子、氯离子;
为带有1个负电荷的阴离子,可能为溴离子、氯离子;
C.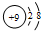 表示的核电荷数为9,为氟元素,核外电子总数-核电荷数=10-9=1,说明带有1个单位负电荷,表示的是氟离子;
表示的核电荷数为9,为氟元素,核外电子总数-核电荷数=10-9=1,说明带有1个单位负电荷,表示的是氟离子;
D. 表示的可以是钠离子、镁离子、氖原子等一类两个电子层、最外层为8个电子的粒子.
表示的可以是钠离子、镁离子、氖原子等一类两个电子层、最外层为8个电子的粒子.
解答 解:A.X-表示带有1个单位负电荷的离子,可以是氯离子、溴离子等,表示的不一定为氟离子,故A错误;
B.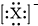 为带有1个负电荷的阴离子的电子式,可以是铝离子、溴离子、碘离子等阴离子,不一定为氟离子,故B错误;
为带有1个负电荷的阴离子的电子式,可以是铝离子、溴离子、碘离子等阴离子,不一定为氟离子,故B错误;
C.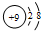 表示的核电荷数为9,为F元素,核外电子总数-核电荷数=10-9=1,说明带有1个单位负电荷,表示的只能是氟离子,故C正确;
表示的核电荷数为9,为F元素,核外电子总数-核电荷数=10-9=1,说明带有1个单位负电荷,表示的只能是氟离子,故C正确;
D. 表示的是含有两个电子层、最外层为8个电子的粒子,可以是钠离子、镁离子、氖原子等一类,不一定为氟离子,故D错误;
表示的是含有两个电子层、最外层为8个电子的粒子,可以是钠离子、镁离子、氖原子等一类,不一定为氟离子,故D错误;
故选C.
点评 本题考查常见化学用语的表示方法,题目难度中等,涉及电子式、粒子结构示意图、电子轨道排布式、离子符号的表示方法等知识,注意掌握常见化学用语的概念及表示方法,正确分析各选项表示的意义为解答本题的关键.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:解答题
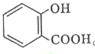 的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式:
的名称为:2-羟基苯甲酸;在核磁共振氢谱中会出现6组峰;写出其与KHCO3溶液反应的化学方程式: +KHCO3→
+KHCO3→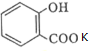 +CO2↑+H2O.
+CO2↑+H2O.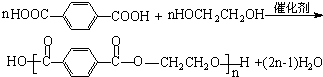 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 将氯化亚铁溶液和氯气反应:Fe2++Cl2═Fe3++2 Cl- | |
| D. | 将铜屑加入含Fe3+的溶液中:2Fe3++Cu═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(CO):点燃 | |
| B. | 硝酸钾(氯化钠):浓溶液降温结晶 | |
| C. | MgSO4(MgCl2):蒸干、灼烧 | |
| D. | 乙酸(乙醛):加新制氢氧化铜浊液加热,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 强酸性溶液中:Na+、K+、NO3-、SiO32- | |
| C. | 可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3- | |
| D. | 使石蕊变蓝的溶液中:Ba2+、Na+、AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2g | B. | 16.8g | C. | 22.4g | D. | 33.5g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com