
| A. | 0.1 mol•L-1Na2CO3溶液:c(Na+)>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$)>c(OH-) | |
| B. | 0.01 mol•L-1CH3COOH溶液,水电离出的c(H+)=10-12mol•L-1 | |
| C. | 0.2 mol•L-1NaClO溶液:c(Na+)═c(ClO-)+c(Cl-)+c(HClO) | |
| D. | pH相同的NH4Cl、(NH4)2SO4溶液:c(NH4Cl)>c[(NH4)2SO4] |
分析 A、碳酸钠溶液中,碳酸根离子部分水解,溶液显示碱性,则c(OH-)>c(H+),根据电荷守恒判断溶液中离子浓度大小;
B、醋酸是弱酸,水电离的氢离子浓度等于溶液中氢氧根离子浓度;
C、根据物料守恒,c(Na+)═c(ClO-)+c(HClO);
D、溶液因铵根离子水解而显酸性,由于1molNH4Cl、(NH4)2SO4溶液中NH4Cl的物质的量为后者的1半,要使pH相等,则需要的NH4Cl比硫酸铵多.
解答 解:A、Na2CO3溶液碳酸根离子水解导致溶液显示碱性,则(OH-)>c(H+),水电离出氢氧根,溶液中离子浓度大小顺序为:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-),故A错误;
B、醋酸是弱酸,水电离的氢离子浓度等于溶液中氢氧根离子浓度,0.01 mol•L-1CH3COOH溶液,由于醋酸为弱酸,无法计算溶液中的氢离子浓度,也就无法计算溶液中的氢氧根离子浓度,故B错误;
C、根据物料守恒,c(Na+)═c(ClO-)+c(HClO),故C错误;
D、溶液因铵根离子水解而显酸性,由于1molNH4Cl、(NH4)2SO4溶液中NH4Cl的物质的量为后者的1半,要使pH相等,则需要的NH4Cl比硫酸铵多,c(NH4Cl)>c[(NH4)2SO4],故D正确.
故选D.
点评 本题考查了盐的水解原理及其影响、离子浓度大小比较,题目难度中等,注意掌握盐的水解原理及影响因素,侧重对教材基础知识的巩固和训练,旨在培养学生灵活运用水解原理解决实际问题的能力,有利于培养学生的应试能力,激发学生学习化学的兴趣.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
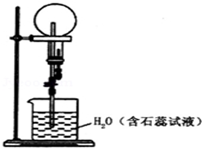 已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )
已知NH3和HCl都能用来作喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行实验(两烧瓶内充满溶液且不考虑溶质的扩散).下列说法正确的是( )| A. | NH3和HCl分别形成红色、蓝色喷泉 | |
| B. | 制备干燥的NH3和HCl,可分别用无水CaCl2、碱石灰干燥 | |
| C. | 改为NO2气体,所得溶液溶质的物质的量浓度与前两者不同 | |
| D. | 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③④⑤ | C. | ③⑤ | D. | ②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油和炭黑 | B. | 石油和焦炭 | C. | 油脂和木炭 | D. | 油脂和石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用碱式滴定管量取15.20 ml 酸性高锰酸钾溶液 | |
| C. | 配制氯化铁溶液时,把氯化铁溶解在一定浓度的盐酸中,再加水稀释 | |
| D. | 用带有橡胶塞的玻璃试剂瓶盛放NaF溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 具有4个官能团,氯原子、苯基、羟基和羧基 | |
| B. | 具有羧基,能与醇类物质发生酯化反应 | |
| C. | 具有酚羟基,所以能与NaHCO3溶液反应生成CO2 | |
| D. | 具有氯原子,在氢氧化钠醇溶液中加热,可发生消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com