
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol•L-1 |
| ② | 298 | 粗颗粒 | 1.00 mol•L-1 |
| ③ | 308 | 粗颗粒 | 2.00 mol•L-1 |
| ④ | 298 | 细颗粒 | 2.00 mol•L-1 |
分析 (1)实验①和②中只有硝酸的浓度不同,探究的是浓度对反应速率的影响;
(2)实验①和③中只有反应温度不同,探究的是温度对反应速率的影响;
(3)实验①和④中只有固体颗粒大小不同,探究的是固体颗粒大小对反应速率的影响.
解答 解:(1)实验①和②的大理石规格、反应温度都相同,只有稀硝酸浓度1个变量,则探究的是浓度对反应速率的影响,
故答案为:浓度;
(2)实验①和③的大理石规格、硝酸浓度相同,只有温度不同,则探究的是温度对反应速率的影响,
故答案为:温度;
(3)实验①和④的温度、硝酸浓度相同,只有固体规格不同,则探究的是固体颗粒大小对反应速率的影响,
故答案为:固体颗粒大小.
点评 本题考查化学反应速率的因素,题目难度不大,明确化学反应速率的影响因素为解答关键,注意掌握对照试验的设计方法,试题有利于提高学生的分析、理解能力及化学实验能力.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:推断题
 ;
; ,写出C2B2与A2B反应的离子方程式2Na2O2+2H2O═4Na++4OH-+O2↑;
,写出C2B2与A2B反应的离子方程式2Na2O2+2H2O═4Na++4OH-+O2↑;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取金属锰 | |
| B. |  制取二氧化碳 | |
| C. |  蒸发饱和食盐水制取食盐晶体 | |
| D. |  验证FeCl3对H2O2分解反应有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
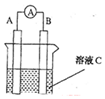 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
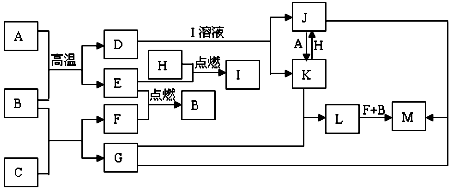
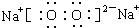 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液溶液变红 | Fe(NO3)2样品已氧化变质 |
| C | 向盛有少量NaHCO3的试管中滴加草酸溶液有气泡产生 | 酸性:草酸>碳酸 |
| D | 向少量某物质的稀溶液中滴加稀盐酸,产生了能使澄清石灰水变浑浊的气体 | 该物质一定是碳酸盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com