
| A. | 质子数:c>b | B. | 离子的还原性:C2-<D- | ||
| C. | 氢化物的稳定性:H2C>HD | D. | 离子半径:B+>A3+ |
分析 短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,结合元素周期律解答.
解答 解:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,
A.B为Na元素,C为O元素,故b=11、c=8,则质子数:b>c,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故B错误;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,非金属性越强氢化物越稳定,故氢化物稳定性:HF>H2O,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径r(Al3+)<r(Na+),故D正确,
故选D.
点评 本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.


 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
| A. | Mg2+、NH${\;}_{4}^{+}$、OH-、SO${\;}_{4}^{2-}$ | B. | Na+、H+、Cl-、HCO${\;}_{3}^{-}$ | ||
| C. | Na+、K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | H++、K+、MnO${\;}_{4}^{-}$、SO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
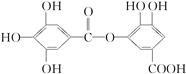 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A. | 酸性条件下可发生水解反应,且产物只有一种 | |
| B. | 1mol该有机物最多可跟8molNaOH反应 | |
| C. | 1mol该有机物最多可跟2molBr2反应 | |
| D. | 该有机物可跟NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )
某溶液中可能含有OH-、CO32-、AlO2-、SiO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入盐酸时,生成沉淀的物质的量与加入盐酸体积的关系如图所示.已知:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-,下列结论不正确的是( )| A. | 原混合溶液中一定含有的离子是OH-、CO32-、AlO2-、SiO32-、Al3+ | |
| B. | AB段反应的离子方程式是H++CO32-═HCO3-,H++HCO3-═CO2↑+H2O | |
| C. | AB段之前反应的离子方程式是AlO2-+HCO3-+H2O═Al(OH)3↓+CO32- | |
| D. | K+、Na+两种离子肯定存在其中一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
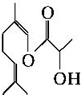
| A. | 1 mol该化合物最多可与2 mol H2反应 | |
| B. | 该化合物能与乳酸发生酯化反应 | |
| C. | 该化合物能与氢氧化钠溶液、溴水反应 | |
| D. | 该化合物的同分异构体可能为芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com