
【题目】现有Fe和Fe2O3组成的混合物27.2g,与100mL一定浓度稀硫酸恰好完全反应,放出标准状况下2.24L H2,向反应后的溶液中滴入KSCN溶液,未见红色。求混合物中Fe的质量____。
【答案】11.2g
【解析】
Fe和Fe2O3组成的混合物与硫酸反应,只有Fe能反应生成H2,Fe2O3与硫酸反应生成Fe3+和水,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,据此分析计算。
Fe和Fe2O3组成的混合物与硫酸反应,只有Fe能反应生成H2,因此生成H2消耗的铁的物质的量为![]() =0.1mol,Fe和Fe2O3组成的混合物与硫酸反应,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,反应方程式为:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,因此有n(Fe)= n(Fe2O3),那么根据Fe和Fe2O3组成的混合物27.2g可得56g/mol×n(Fe)+0.1mol×56g/mol+160g/mol×n(Fe2O3)=27.2,解得n(Fe)= n(Fe2O3)=0.1mol,混合物中Fe的质量m(Fe)=(0.1mol+0.1mol)×56g/mol=11.2g。
=0.1mol,Fe和Fe2O3组成的混合物与硫酸反应,向反应后的溶液中滴入KSCN溶液,未见红色,说明单质铁将所有的Fe3+还原为了Fe2+,反应方程式为:Fe+Fe2O3+3H2SO4=3FeSO4+3H2O,因此有n(Fe)= n(Fe2O3),那么根据Fe和Fe2O3组成的混合物27.2g可得56g/mol×n(Fe)+0.1mol×56g/mol+160g/mol×n(Fe2O3)=27.2,解得n(Fe)= n(Fe2O3)=0.1mol,混合物中Fe的质量m(Fe)=(0.1mol+0.1mol)×56g/mol=11.2g。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】将6 g的铁粉加入200 mL Fe2(SO4)3和CuSO4的混合溶液中,充分反应可以得到200 mL 0.5mol /L FeSO4溶液和5.2 g固体沉淀物。试计算原混合溶液中Fe2(SO4)3的物质的量浓度_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(52Te)被誉为“国防与尖端技术的维生素”;锡酸钠可用于制造陶瓷电容器的基体,陶瓷电容器在宇航、导弹、航海等方面有着重要的用途。以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠和碲的流程图如图:
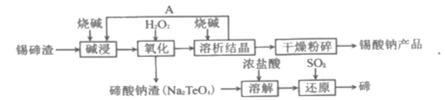
已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
(1)在生产过程中,要将锡碲渣粉碎,其目的是___。
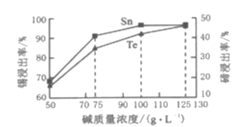
(2)“碱浸”过程中,锡碲浸出率与溶液中碱的质量浓度关系如图所示,最理想的碱的质量浓度为100g/L,其理由是___。
(3)“氧化”时,反应的离子方程式为___;“氧化”的温度控制在60℃~70℃之间,其原因是___。
(4)“还原”反应的化学方程式为___。
(5)以石墨为电极电解Na2TeO3溶液可获得Te,电解过程中阴极上的电极反应为___。
(6)常温下,向lmolL-1Na2TeO3溶液中滴加盐酸,当溶液中c(TeO32-):c(H2TeO3)=0.2时,pH=___。(已知:H2TeO3的电离平衡常数Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B.100g46%的甲酸(HCOOH)水溶液中所含的氧原子数目为5NA
C.lmol铁粉高温下与足量水蒸气反应,转移电子数为3NA
D.2molSO2和lmolO2在催化剂作用下充分反应所得分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
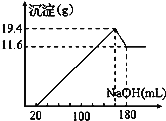
【题目】取50 mL某浓度的稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5 mol/L NaOH溶液至过量,生成沉淀的质量与加入NaOH溶液体积的关系如图所示。求原硫酸的物质的量浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型微生物电池可利用生活垃圾发电,其工作原理如图所示,下列有关说法中错误的是( )
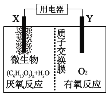
A.X电极的反应式为:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24nH+
B.每消耗1molO2时会有4mol质子通过质子交换膜
C.工作时外电路电流由负极流向正极
D.微生物所起作用与催化剂相当
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种常用氧化剂,主要用于化工、防腐及制药工业等。可将软锰矿(主要成分为MnO2)和KClO3在碱性介质中制得K2MnO4,然后通入CO2制备高锰酸钾。已知:
温度 | 溶解度/g | ||||
K2CO3 | KHCO3 | KMnO4 | K2SO4 | CH3COOK | |
20℃ | 111 | 33.7 | 6.38 | 11.1 | 217 |
(1)制备锰酸钾的主要反应为:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O
①该反应中的氧化剂是_____________,还原剂是_____________。
②每生成 1mol K2MnO4转移_______ mol 电子。
(2)通入少量CO2气体时,锰酸钾发生歧化反应,生成KMnO4,MnO2,K2CO3。
①则生成的 KMnO4与MnO2的物质的量之比为__________。
②若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低,其原因是______________________________,可以把通CO2改为加其他的酸。从理论上分析,选用下列酸中_______,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含 Na2CO3·xH2O和 NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的 CO2 和 H2O的质量,来确定 Na2CO3··xH2O中 x的数值。
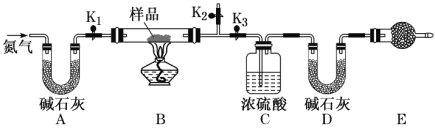
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,检查装置的气密性。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶 C 的质量和盛装碱石灰的 U形管 的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入氮气数分钟,其目的是_________________________。
④关闭活塞K1、K2,打开 K3,点燃酒精灯,加热至不再产生气体。加热时 NaHCO3 发生反应的化学方程式为___________________________________。
⑤打开活塞 K1,缓缓鼓入氮气数分钟,然后拆下装置,再次称量洗气瓶C的质量和 U形管 D的质量。
(2)关于该实验方案,请回答下列问题。
①装置 E的名称是_________,E中盛放的试剂也是碱石灰,其作用是_______________________________。
②若样品质量为 29.3 g,反应后 C、D 装置增加的质量分别为 9 g、4.4 g,则 Na2CO3·xH2O中x为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com