
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(C1-)+c(ClO- )+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(OH+)>c( H2CO3) | |
| C. | pH=ll的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.2 mol•L-l CH3COOH溶液与0.1 mol•L-l NaOH溶液等体积混合:2c(H+)-2c(OH-)=C(CH3COO-)-c(CH3COOH) |
分析 A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.NaHCO3溶液的pH=8.3,溶液呈碱性,说明HCO3-的水解程度大于其电离程度;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性;
D.0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.NaHCO3溶液的pH=8.3>7,溶液呈碱性,说明HCO3-的水解程度大于其电离程度,且水解程度较小,则溶液中离子浓度大小为:c(Na+)>c(HCO3-)>c(OH-)>c( H2CO3),故B正确;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),正确的离子浓度大小为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故C错误;
D.0.2 mol•L-1 CH3COOH溶液与0.1 mol•L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),所以得2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确;
故选BD.
点评 本题考查离子浓度大小比较,为高考高频点,正确判断溶液中溶质及其物质的量,再结合溶液酸碱性、原子守恒、电荷守恒分析解答即可,注意:电解质溶液中存在电荷守恒和物料守恒与电解质强弱、溶液浓度无关.


科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子层数越多,原子半径越大 | |
| B. | 每一主族所含非金属元素的种类可表示为︳族序数-2? | |
| C. | 根据泡利原理将氧元素基态原子的电子排布图书写为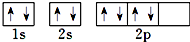 | |
| D. | C2H2分子中的碳采取sp2杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+Q2>Q3 | B. | 2Q1+Q2>2Q3 | C. | 2Q1+Q2<2Q3 | D. | Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )
咖啡酸(如图),存在于许多中药,如野胡萝卜、光叶水苏、荞麦等中.咖啡酸有止血作用.下列关于咖啡酸的说法不正确的是( )| A. | 咖啡酸的分子式为C9H8O4 | |
| B. | 1mol咖啡酸可以和含4molBr2的浓溴水反应 | |
| C. | 1mol咖啡酸可以和3molNaOH反应 | |
| D. | 可以用高锰酸钾检验出咖啡酸分子中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是表示物质所含质量多少的单位 | |
| B. | 摩尔质量就等于物质式量的6.02×1023倍 | |
| C. | HNO3的摩尔质量是63g | |
| D. | 硫酸和磷酸的摩尔质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C2H6 | D. | C4H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评价 |
| ① | 硫酸溶液中加入Ba(OH)2溶液 | Ba2++SO42-═BaSO4↓ | 正确 |
| ② | 氧化铝与NaOH溶液反应 | 2Al3-+302-+20H- ═2AlO2-+H20 | 错误,Al203不应写成离子 形式 |
| ③ | 铁和足量稀硝酸反应 | Fe+2H+═H2↑+Fe2+ | 正确 |
| ④ | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | 错误,离子方程式中Fe2+与Br-的物质的量之比与化学式不符 |
| A. | ① | B. | ①③ | C. | ②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA | |
| B. | pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 0.1 mol Na2O2晶体中含有0.3NA个离子 | |
| D. | 标准状况下,22.4L甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com