
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤对电子数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是____________(写分子式),它们的稳定性由弱到强的顺序是_______________________________________________________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是_______ _(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
_(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)C的单质分子中存在________个π键、________个σ键。
科目:高中化学 来源: 题型:
(1)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热到1 100~1 300 ℃,使锌蒸馏出来。
①写出火法炼锌的主要反应:
焙烧反应:_________________________________________。
鼓风炉中可能发生的反应:___________________(任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?_____________________________________________________________________________。
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品________(填物质名称)。
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF6),其作用是________________________________________________。
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是
______________________________________________________。
(3)工业上“联合制碱法”中主要反应的化学方程式是_______________________________________。
其中的CO2来源于______________。
(4)碳酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为CaCO3+SiO2CaSiO3+CO2↑,若在上述条件下,把1 000a g CaCO3和60a g SiO2混合,则生成的CO2在标准状况下的体积为________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产硫酸的流程图如下:

请回答下列问题:
(1)早期生产硫酸以黄铁矿为原料,但现在工厂生产硫酸以硫黄为原料,理由是________________________________________________________________________。
(2)在气体进入催化反应室前需净化的原因是_________________________ ________
________
_____________________ ___________________________________________________。
___________________________________________________。
(3)在催化反应室中通常使用常压,在此条件下SO2的转化率为90%。但是部分发达国家采取高压条件下制取SO3,采取加压措施的目的除了加快反应速率外,还可以____________________________,从而提高生产效率。
(4)工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染,废物利用的目的。用化学方程式表示其反应原理:____________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)除硫酸工业外,还有许多工业生产。下列相关的工业生产流程中正确的是________。
A.海水提溴:海水浓缩
 溴蒸气
溴蒸气

 液溴
液溴
B.海水提镁:海滩贝壳
 石灰水
石灰水

 MgO
MgO 镁
镁
C.工业制硝酸:空气 NO2
NO2 硝酸—→尾气处理
硝酸—→尾气处理
D.工业合成氨:天然气 氢气
氢气 NH3、H2、N2
NH3、H2、N2 氨
氨
查看答案和解析>>
科目:高中化学 来源: 题型:
元素H、C、N、O、F都是重要的非金属元素,Fe、Cu是应用非常广泛的金属。
(1)Fe元素基态原子的核外电子排布式为 。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数比为 。
(3)C、N、O三种元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(4)在测定HF的相对分子质量时,实验测得值一般高于理论值,其主要原因是
。
(5)C、N两元素形成的化合物C3N4形成的原子晶体,结构类似金刚石,甚至硬度超过金刚石,其原因是
。
(6)如图为石墨晶胞结构示意图,该晶胞中含有C原子的个数为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:_____________________,
其中含有的化学键是______________,属于晶体类型为________。
(2)用电子式表示Y2O的形成过程______________________。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是________(填化学式)。
(4)XH3、H2Z和HW三种化合物,其空间构型分别为________、________、________。其中一种与另外两种都能反应的是______________(填化学式),其生成物晶体类型分别属于________、________。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中 ,溶液内发生反应的离子方程式,其中不正确的是
,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA为阿伏加德罗常数的值)( )
A.常温常压下,22.4 L CO2中含有NA个CO2分子
B.标准状况下,22.4 L空气含有NA个单质分子
C.22.4 L Cl2中含有NA个Cl2分子
D.标准状况下,1.12 L O2和1.12 L CO 2均含0.1NA个氧原子
2均含0.1NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是 ( )
)
A.Ba2+、NO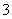 、NH
、NH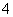 、Cl-
、Cl-
B.Ca2+、HCO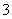 、NH
、NH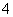 、AlO
、AlO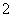
C.K+、Ba2+、Cl-、HSO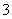
D.Mg2+、NH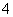 、SO
、SO 、K+
、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com