
| 实验装置与现象 | |||
| 装置 | 甲 | 乙 | 丙 |
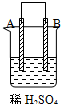 | 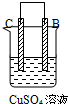 | 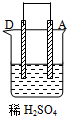 | |
| 现象 | A不断溶解 | C的质量增加 | A上有气体产生 |
| A、装置甲中的B金属是原电池的负极 |
| B、装置乙中的C金属是原电池的阳极 |
| C、装置丙中的D金属是原电池的正极 |
| D、四种金属的活泼性顺序是D>A>B>C |


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
| A、Na+、Cu2+、Cl-、SO42- |
| B、Pb2+、NH4+、Cl-、SO42- |
| C、NH4+、Na+、CH3COO-、NO3- |
| D、K+、Fe3+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
293 118 |
| A、0 | B、57 | C、118 | D、175 |
查看答案和解析>>
科目:高中化学 来源: 题型:

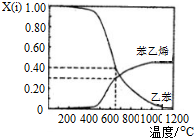
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1项 | B、2项 | C、3项 | D、4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
c(N
| ||
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中分子数为0.5NA |
| C、7.8gNa2O2固体中阴、阳离子总数为0.3NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
| B、SO2具有漂白性可以是酸性高锰酸钾溶液褪色 |
| C、实验室可用NaOH溶液处理NO2和SO2废气 |
| D、稀硝酸、稀硫酸均能将木炭氧化成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、0.5mol雄黄(As4S4,结构如图)含有NA个S-S键 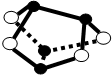 |
| B、1mol/L(NH4)2SO4溶液中,含SO42-NA个,NH4+少于2NA个 |
| C、23g钠与一定量的氧气作用,若两者均无剩余,转移NA个电子 |
| D、将含0.1 mol FeCl3的溶液滴加到沸水中完全水解可生成0.1 NA个Fe(OH)3胶粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com