


分析 粗铜和氯气反应生成氯化铜和氯化铁,加入盐酸至固体完全溶解,得到溶液1,加入氧化铜调节溶液PH除去铁离子,过滤得到氯化铜溶液,蒸发浓缩,冷却结晶,过滤洗涤得到氯化铜晶体,
(1)①仪器A是分液漏斗;
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水;
③氯化氢气体和铜不反应,不影响氯气和铜发生的反应;
④实验中的反应物之一为氯气,能污染大气,所以需要处理尾气;
(2)①生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值为平衡常数,注意水量的改变对水的浓度变化影响极小,所以水的浓度是一个常数,此常数可归并到平衡常数中去;平衡常数只受温度影响,与离子浓度无关;
②根据平衡移动原理分析.
解答 解:(1)①仪器A是分液漏斗,故答案为:分液漏斗;
②装置B中制取氯气,二氧化锰与浓盐酸发生反应生成氯化锰、氯气、水,反应离子方程式为MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
③氯化氢气体和铜不反应,不影响氯气和铜发生的反应,没有必要增加吸收HCl的装置,
故答案为:否;
④实验中的反应物之一为氯气,能污染大气,所以需要处理尾气,一般用NaOH溶液吸收,
故答案为:NaOH溶液,吸收多余的氯气,防止空气污染;
(2)①Cu(H2O)42+(aq)+4Cl-(aq)?CuCl42-(aq)+4H2O(l)的平衡常数为k=$\frac{c(CuC{{l}_{4}}^{2-})}{c[Cu({H}_{2}O{)_{4}}^{2+}]•{c}^{4}(C{l}^{-})}$,平衡常数随温度变化,若增大氯离子浓度,K值不变,
故答案为:$\frac{c(CuC{{l}_{4}}^{2-})}{c[Cu({H}_{2}O{)_{4}}^{2+}]•{c}^{4}(C{l}^{-})}$,不变;
②现欲使溶液由黄色变成蓝色,平衡逆移,可以加水稀释或者加硝酸银溶液来减小减少Cl-的浓度,
故答案为:加水稀释,加硝酸银溶液.
点评 本题考查学生对工艺流程理解、实验装置的理解、平衡移动、平衡常数,物质分离提纯等,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青蒿素 | B. | 青霉素 | C. | 虾青素 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制备水杨酸对正辛基苯基酯(
制备水杨酸对正辛基苯基酯( )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑ ],温度控制在100℃左右,不断搅拌.
],温度控制在100℃左右,不断搅拌. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 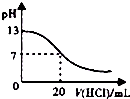 如图表示室温时,用0.1 mol.L-1 盐酸滴定0.1 mol•L-1NaOH溶液过程中的pH变化 | |
| B. | 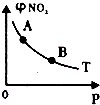 T℃时,反应2NO2(g)  N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图所示,则A点的颜色深,B点的颜色浅 | |
| C. | 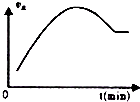 如图表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g)?2C(g)达到平衡,正反应速率随时间变化的示意图.由图可得出的结论是:反应物的总能量低于生成物的总量 | |
| D. | 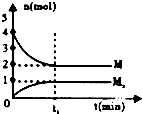 如图在恒温恒容的密闭容器中,气体M存在如下关系xM(g)?Mx(g),t1时刻,保持温度不变,再充入1mol M,重新达到平衡时$\frac{c(Mx)}{c(M)}$将增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com