
分析 (1)铵根离子(NH4+)存在4个氮氢键,带一个单位的正电荷;
(2)分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,在 AgI 沉淀中加入硫化钠溶液,黄色沉淀转化为黑色沉淀Ag2S,据此书写离子方程式;
(4)根据氧化还原反应中得失电子相等来配平方程式.
解答 解:(1)铵根离子(NH4+)存在4个氮氢键,带一个单位的正电荷,铵根离子的结构式为: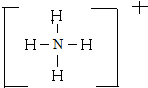 ,
,
故答案为: ;
;
(2)反应前S为+6价,反应后为+4,化合价降低2,钙、硅化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:2CaSO4+2SiO2$\frac{\underline{\;高温\;}}{\;}$2CaSiO3+2SO2↑+O2↑,
故答案为:2CaSO4+2SiO2$\frac{\underline{\;高温\;}}{\;}$2CaSiO3+2SO2↑+O2↑;
(3)Ksp(AgI)>Ksp(Ag2S),在 AgI 沉淀中加入硫化钠溶液,黄色沉淀AgI 转化为黑色沉淀Ag2S,离子方程式为:2AgI+S2-?Ag2S+2I-,
故答案为:2AgI+S2-?Ag2S+2I-;
(4)1mol高锰酸根离子参加氧化还原反应得到5mol电子,1molCH3CH2OH参加氧化还原反应失去4mol电子,所以得失电子的最小公倍数是20,则高锰酸根离子的计量数是4,CH3CH2OH的计量数是5,其它原子根据原子守恒来配平,所以该方程式为:4MnO4-+5CH3CH2OH+12H+=4Mn2++5CH3COOH+11H2O.
故答案为:4、5、12H+、4、5、11H2O.
点评 本题考查了常用化学用语的书写,涉及结构式、沉淀的转化、离子方程式书写等知识,掌握沉淀溶解平衡的转化,氧化还原反应原理等知识是解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
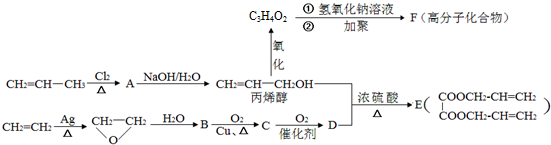
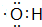 ;丙烯→A的反应类型为取代反应.
;丙烯→A的反应类型为取代反应.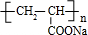 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
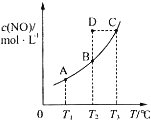 在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:| A. | 该反应的Q>0 | |
| B. | 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| C. | 在T2时,若反应体系处于状态D,则此时V正>V逆 | |
| D. | 若状态B、C、D的压强分别为PB、PC、PD,则 PC=PD>PB |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com