
����Ŀ��
(1)�����£�����������������ʢװŨ�����ԭ���� ��
(2)����������������װNaOH�ȼ���Һ��ԭ����(�����ӷ���ʽ��ʾ) ��
(3)��ҵ��ұ��������Ӧ�Ļ�ѧ����ʽΪ ��
(4)ijʵ��С��������ͼװ����֤����ˮ�����ķ�Ӧ��
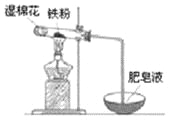
��ʪ���������� ���Թ��з�Ӧ�Ļ�ѧ����ʽ�� ��
��ʵ�������ȡ��������Ӧ��Ĺ������Թ��У�����������ᣬ������ȫ�ܽ⣬������Һ�д��ڵ��������� (�����)��
a��һ����Fe2+��H+��Fe3+b��һ����Fe2+��H+��������Fe3+
c��һ����Fe2+��Fe3+��������H+d��һ����Fe3+��H+��������Fe2+
���𰸡�(1)Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)
(2)2Al+2OH��+6H2O=2[Al(OH)4]��+3H2��
(3)2Al2O3![]() 4Al+3O2��
4Al+3O2��
(4)���ṩˮ������3Fe+4H2O(g)![]() Fe3O4+4H2����b
Fe3O4+4H2����b
�����������������(1)�����£�Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)����������������ʢװŨ���ᣬ�ʴ�Ϊ��Ũ����ʹ�����������γ�һ�������ȶ�������Ĥ(��ʹ�������ۻ�)��
(2)������NaOH��Һ��Ӧ����Ӧ�����ӷ���ʽΪ2Al+2OH��+6H2O=2[Al(OH)4]��+3H2�����ʴ�Ϊ��2Al+2OH��+6H2O=2[Al(OH)4]��+3H2����
(3)��ҵ���õ���������ķ���ұ��������Ӧ�Ļ�ѧ����ʽΪ2Al2O3![]() 4Al+3O2�����ʴ�Ϊ��2Al2O3
4Al+3O2�����ʴ�Ϊ��2Al2O3![]() 4Al+3O2����
4Al+3O2����
(4)����Ϊ������ˮ�����ķ�Ӧ���Թ��������ۣ�����ʪ����Ҫ���ṩˮ���������ڸ�������ˮ��Ӧ������������������������Ӧ����ʽΪ��3Fe+4H2O![]() Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O
Fe3O4+4H2���ʴ�Ϊ���ṩˮ������3Fe+4H2O![]() Fe3O4+4H2��
Fe3O4+4H2��
������ˮ������Ӧ������Ϊ����������������������������ᣬ������ȫ�ܽ⣬�ط�����Ӧ��Fe3O4+8HCl=FeCl2+2FeCl3+4H2O������������Һ�д��ڵ���������һ����Fe2+��H+��������������ɫ�����п��ܺ��й������������ܽ�����������ȫ��ת���ɶ��������ӣ�Fe+2Fe3+�T3Fe2+������������Һ�д��ڵ���������һ����Fe2+��H+��������Fe3+���ʴ�Ϊ��b��


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��RԪ�صĵ���4.5g�������������ᷴӦ����R2��SO4��3�����ų�5.6L��H2����״���£�������
��1��R�����ԭ������Ϊ
��2����Rԭ��������������������1����R�ǣ���Ԫ�ط��ţ� ������Ԫ�����ڱ���λ��Ϊ�� ���ڵ� �壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A��1 mol��������ˮ������2 mol CH3CH2OH��2 mol CO2
B���ڼ�������Һ�зֱ���뱥��Na2SO4��CuSO4��Һ��������������������
C����֬���Ǹ߷��ӻ����1 mol��֬��ȫˮ������1 mol���ͺ�3 mol��֬����
D������������ˮ������Ƿ���л�ԭ�ԣ�����ˮ������Һ��ֱ�Ӽ������Ƶ�Cu(OH)2����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ij����ķ���Ϊ˫ԭ�ӷ��ӣ���Ħ������ΪM gmol��1�����б�״����V L�����壬�谢���ӵ�������ֵΪNA����
�ٸ���������ʵ���Ϊ mol��
�ڸ�������������ԭ������Ϊ ��
�۸������ڱ�״���µ��ܶ�Ϊ gL��1��
�ܸ������һ�����ӵ�����Ϊ g��
��2�����廯����A����ʽ�ɱ�ʾΪOxFy����֪ͬ��ͬѹ��10mL A���ȷֽ�����15mL O2��10mL F2����A�Ļ�ѧʽΪ ���ƶϵ�����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���ķ���ʽΪC10H14��������ʹ��ˮ��ɫ������ʹ����KMnO4��Һ��ɫ�����ӽṹ��ֻ����һ�������������������������( )
A��2�� B��3��
C��4�� D��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��2����ѧ�뼼����
ij���������̿�MnO2Լ70% ��A12O3������п��ZnSԼ80����FeS����ͬ����MnO2��Zn���ɵ��ԭ�ϣ���

��֪����A��![]() �Ļ��Һ��
�Ļ��Һ��
��IV�еĵ�ⷽ��ʽΪ��![]()
��l��A�����ڻ�ԭ�������________________________��
��2������MnCO3��Zn2��OH��2CO3������ ________________________��
II��Ҫ���ȵ�ԭ���ǣ�____________________��C�Ļ�ѧʽ�� _______________��
��3���������г��õ�MnO2��Zn���⣬���ɵõ��ĸ���Ʒ��_________________��
��4����������������е���ģ�����ʯ�⣬�蹺��Ļ���ԭ����_____________��
��5��Ҫ��Na2SO4��Һ�еõ�â����Na2SO4��10H2O��������еIJ���������Ũ����___________�����ˡ�ϴ�ӡ�����ȡ�
��6��������MnO2��Zn�ĽǶȼ��㣬���̿����п��������ȴ�Լ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ի�ͭ����Ҫ�ɷ���CuFeS2������������SiO2��Ϊԭ����ͭ�ķ����в�ͬ��ұ������������ͭ������ͭ��Cu2S���ڿ����и��±��ռ��ɵõ�ͭ��һ�ֻ�ԭ�Ե����塣��������ʪ����ͭ�����½�չ����ѧ�ҷ�����һ��ϸ��������ˮ��Һ�����������£����Խ���ͭ�������������Ρ�ij�������ø�ԭ������ͭ���̷���FeSO47H2O���Ĺ������£�
�ش��������⣺
��1������ͭ�����Ļ�ѧ����ʽ��_________________________��
��2��ʪ����ͭ���������У�Ϊ��������ʱ�Ľ�ȡ�ʣ������̿ɲ�ȡ�Ĵ�ʩ��________���Լ�XΪ__________����������_____________��
��3���Լ�aΪ______________���Լ�bΪ______________��
��4����ƽ��Ӧ1�Ļ�ѧ����ʽ��____CuFeS2+___H2SO4+____O2=____CuSO4+____Fe2��SO4��3+____H2O
��5����֪��������Ksp[Cu��OH��2]=2.2��10-20��Ksp[Fe��OH��3]=2.6��10-39������������Լ�X����pH=4ʱ����ʹ��Һ�е�Fe3+ת��ΪFe��OH��3����������Һ�е�c��Fe3+��=___________����Ҫ��ʱ������Cu��OH��2����������Һ�е�Cu2+Ũ�������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±��ṩ������(�г��������Լ���ѡ)����ʵ����Ӧʵ��Ŀ�ĵ���( )
ѡ�� | ʵ��Ŀ�� | �� �� |
A | ��ȥ�������������е���ɳ | ©��(����ֽ)���ձ��������� |
B | ��ʳ��ˮ�л��NaCl���� | ���������������ƾ��ơ������� |
C | ��0.10 mol��L��1������ⶨδ֪Ũ�ȵ�NaOH��ҺŨ�� | ��ʽ�ζ��ܡ���ʽ�ζ��ܡ���ƿ����ͷ�ιܡ��ձ� |
D | ��MnO2��Ũ������ȡ���������Cl2 | Բ����ƿ����Һ©�����ƾ��ơ�ϴ��ƿ������ƿ�����ܡ�ʯ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�����ʯ����ˮ��Ӧ���������ȷ�Ӧ������ʵ��̽�����ڳ������ִ���ʽ��ڸо������⣬����������м��������Է�����
���������¶ȼ���ʢ������ʯ�ҵ�С�Թ�����Ƥ��������һ�𣬷�����ˮ��С�ձ��У�����ͷ�ι���С�Թ��л�������ˮ��������������______��˵����Ӧ������������װ����֧�ż��������������ȥ��

�ҷ�������ʢ������ʯ�ҵ�С�Թܲ����֧�ܵ��Թ��У�֧�ܽ����������ý�ͷ�ι���С�Թ��л�������ˮ��������������(����)________(����)________��˵����Ӧ���ȡ�
���������ý�ͷ�ι���ʢ������ʯ���Ҵ�֧�ܵ��Թ��еμ�ˮ��֧�ܽӵĵ�����ʢ������ˮ����ͭ��ĩ��������������______________��˵����Ӧ���ȣ���ԭ����_____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com