
| A. | 适当升高温度 | B. | 将锌粒改为锌粉 | ||
| C. | 将所用硫酸加适量水适当稀释 | D. | 寻找一种合适的催化剂并加入其中 |
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
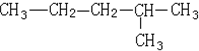
| A. | 该有机物属于饱和烷烃 | |
| B. | 该有机物可由两种单炔烃分别与氢气加成得到 | |
| C. | 该烃与2,3-二甲基丁烷互为同系物 | |
| D. | 该烃的一氯取代产物共有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
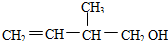 下列的叙述错误的是( )
下列的叙述错误的是( )| A. | 此有机物的官能团是羟基和碳碳双键 | |
| B. | 能在催化剂条件下与H2发生加成反应 | |
| C. | 此有机物不能发生加聚反应 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂的水解反应又叫皂化反应 | |
| B. | “低碳”是指采用含碳量低的烃类作为燃料 | |
| C. | 银质物品久置在空气中表面变黑,是电化学腐蚀引起的 | |
| D. | 皮肤、指甲不慎沾上浓硝酸,会发生颜色反应而变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH3+Br2$\stackrel{光照}{→}$ CH3CH2Br+HBr | B. | CH2=CH2+HBr-→CH3CH2Br | ||
| C. | 2C2H2+5O2$\stackrel{点燃}{→}$ 4CO2+2H2O | D. | C4H10$\stackrel{高温}{→}$ C2H4+C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
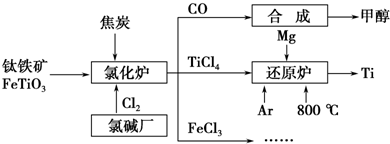
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com