
| 实验 | 现象 | 结论 |
| 通入KMnO4(H+) | ||
| 通入溴的CCl4溶液 | ||
| 点燃 |
| 实验 | 现象 | 结论 |
| 通入KMnO4(H+) | 紫色溶液褪色 | 乙烯能被酸性高锰酸钾溶液氧化 |
| 通入溴的CCl4溶液 | 红棕色褪去 | 乙烯能与溴发生加成反应 |
| 点燃 | 火焰明亮并伴有少量黑烟 | 乙烯能被氧气氧化 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、6.8g熔融的KHSO4中含有0.1NA个阳离子 |
| B、0.1mol Na2O2晶体中含有0.1NA个阴离子 |
| C、在25℃时,1L 1mol/L醋酸溶液中所含分子的个数大于NA |
| D、在标准状况下的22.4L辛烷完全燃烧,生成的二氧化碳的分子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
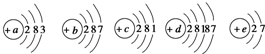 已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:
已知元素aA、bB、cC、dD、eE的原子结构示意图分别为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com