
| A. | 8种 | B. | 4种 | C. | 3种 | D. | 2种 |
分析 某种有机物甲的分子式为C5H10O2,能发生水解反应,水解产物为乙和丙,则有机物甲为酯.由于同质量的乙和丙的蒸气所占体积相同,说明乙和丙的相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有2个C原子,而得到的醇含有3个C原子,判断3碳醇属于醇的同分异构体,2碳羧酸属于羧酸的异构体数目.据此判断有机物甲的同分异构体数目.
解答 解:某种有机物甲的分子式为C5H10O2,能发生水解反应,水解产物为乙和丙,则有机物甲为酯.由于同质量的乙和丙的蒸气所占体积相同,说明乙和丙的相对分子质量相同,因此酸比醇少一个C原子,说明水解后得到的羧酸含有2个C原子,而得到的醇含有3个C原子,2个碳原子的羧酸没有同分异构体,3碳醇有2种,1-丙醇和2-丙醇,所以有机物甲的同分异构体数目有1×2=2,
故选D.
点评 本题主要考查同分异构体数目的判断,难度中等,清楚饱和一元醇与少一个C原子的饱和一元羧酸的相对分子质量相同是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁、NaOH溶液 | B. | 铜、稀硫酸 | C. | 锌、浓硝酸 | D. | 铁、FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
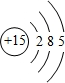 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
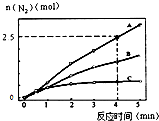
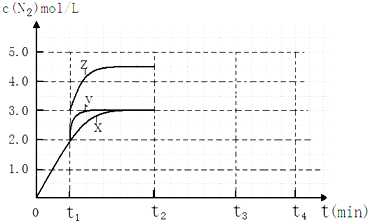
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的主族序数与周期数的差为4,且不与A元素在同一周期 |
| E是第四周期中含未成对电子数最多的元素 |
| F基态原子外围电子排布式为(n+1)d3n(n+2)Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
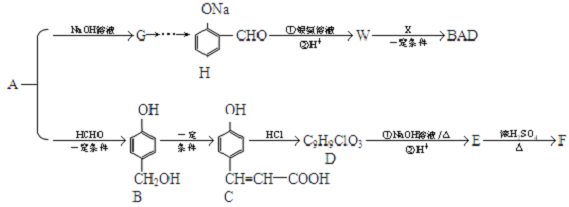
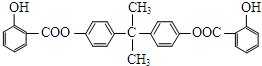
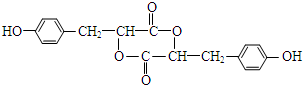
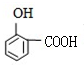 .
.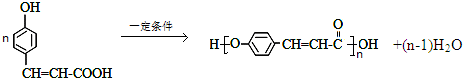 .
.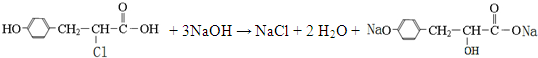 .
.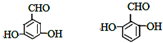 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com